Vad är colony PCR?
Colony PCR är en snabb PCR-metod med hög genomströmning för att bestämma närvaron eller frånvaron av det införda DNA i plasmid direkt från bakteriekolonierna.
molekylär kloning är en av de mest populära metoderna för DNA-transformation sedan länge. För att bestämma närvaron eller frånvaron av DNA-insatsen måste vi emellertid utföra transformationsexperiment.
Colony PCR är en ny metod där vi genom att utforma de införda DNA-specifika primrarna kan identifiera om vårt DNA av intresse sätts in i plasmid eller inte.
det är dock inte så enkelt som vi diskuterar.
i den här artikeln kommer vi att fokusera på kolonin PCR särskilt, principen för kolonin PCR, dess fördelar och begränsningar.
för det måste vi förstå flera termer och ämnen. Vi börjar vårt ämne från grunderna. Innehållet i artikeln är,
viktiga ämnen:
“en plasmid är det bakteriella cirkulära DNA som replikerar oberoende av bakteriekromosomen och används vid genmanipulation och genöverföring.”
genetisk kloning är ett traditionellt molekylärt genetiskt verktyg som används sedan länge i laboratorierna. Kortfattat, i genkloningen, sätts genen av vårt intresse in i plasmid genom artificiella medel. Detta DNA replikeras oberoende av bakteriekromosomen.
plasmider används faktiskt för att generera många kopior av korta segment av DNA. Eftersom bakterier replikerar snabbare än andra organismer kan vi generera många kopior av genen av vårt intresse genom att sätta in den i bakterieplasmiden.
F-plasmid, kol-plasmid, nedbrytande – plasmid och resistensplasmid är flera vanliga typer av plasmider som finns i bakterier.
dessutom kan plasmid fungera som en molekylär bärare som överför korta DNA-segment från en cell till en annan cell.
vi har täckt en fantastisk djupgående artikel om plasmid-DNA. Läs det här: Plasmid DNA-struktur, funktion, isolering och applikationer.
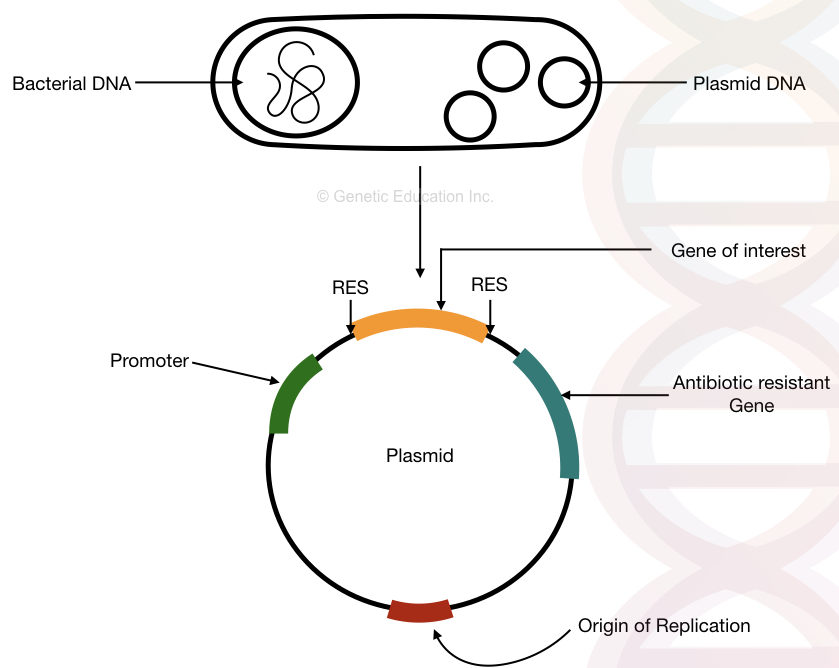
strukturen av bakteriell plasmid-DNA med, ursprunget till replikation, antibiotikaresistensgen, promotor och Gen av intresse.
förutom bakterier innehåller flera andra prokaryoter också plasmid-DNA. Plasmidens huvudsakliga funktion i bakterier är för deras överlevnad under de svåra förhållandena.
när plasmid överför genen av vårt intresse är det mycket viktigt att avgöra om vår gen av intresse sätts in eller inte i plasmid.
för det kan vi använda flera metoder som PCR och mikrobiell odling.
plattning av kolonierna tar längre tid och metodens känslighet är inte heller bra. Risken för kontaminering är alltid hög i bakterieodlingsmetoder.
så resultaten är inte korrekta.
vår PCR hjälper också här. Med colony PCR-metoden kan en DNA-insats bestämmas eller identifieras.
- hur man ställer in ett DNA-extraktionslaboratorium: en omfattande guide (kemikalier, instrument och andra verktyg).
- kromosom 6P deletion: en anledning till ingen smärta, ingen hunger och ingen sömn
Vad är koloni PCR?
Colony PCR är modifieringen av den konventionella PCR där bakteriekolonierna används direkt som en PCR-Mall.
plasmid-DNA som innehåller DNA av vårt intresse förstärks i de cykliska temperaturberoende förhållandena.
den grafiska representationen av kolonin PCR visas i figuren nedan,
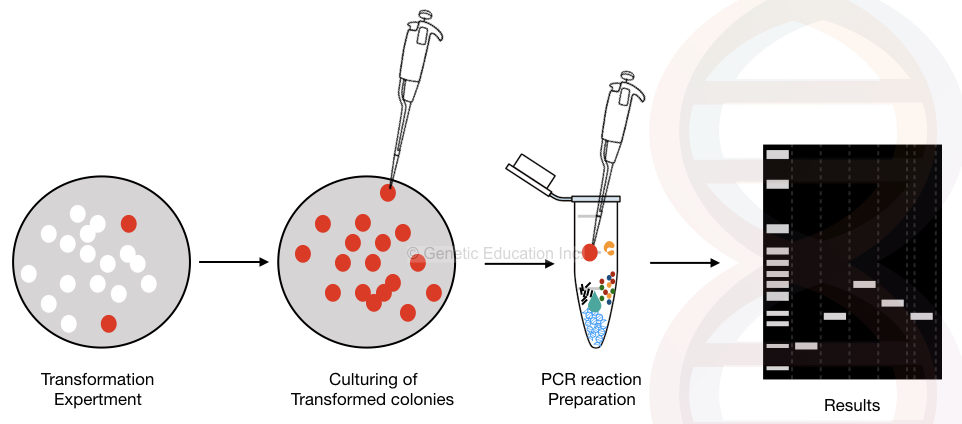
den allmänna översikten över colony PCR-metoden.
princip för koloni PCR:
bakteriekolonin som innehåller plasmid kan direkt förstärkas med två uppsättningar primers. De infoga specifika primrar som förstärker införingssekvensen och vektorspecifika flankerande primrar, som förstärker plasmid-DNA annat än det införda DNA (flankerande regioner på båda sidor av insatsen).
genom att använda insert flanking primers (som förstärker resten av DNA) kan storleken på vår DNA-insats bestämmas.
en bakteriekoloni plockas och tillsätts direkt i mastermixen som innehåller alla PCR-reagenser. Dessutom, genom att lägga till ett initialt uppvärmningssteg till PCR, kommer plasmid-DNA ut från bakteriecellen och förstärks i reaktionen.
detta är grundprincipen för kolonin PCR, men den kan modifieras beroende på kraven.
protokollet för koloni PCR:
kolonin PCR är en av de utmärkta modifieringarna av konventionell PCR. Istället för mall-DNA tillsätts bakteriekolonierna direkt till reaktionen. Förutom detta, Taq DNA-polymeras, primers, PCR-reaktionsbuffert och DD/W tillsätts också i PCR-reaktionen.
här i kolonin PCR är valet av primers mycket viktigt. Valet av primers beror också på syftet med vårt experiment.
vilken typ av information vill vi ha från vårt colony PCR-experiment?
-
-
- Information om närvaron eller frånvaron av insatsen endast.
- Information om storleken på insatsen.
- Information om orienteringen av insatsen.
-
beroende på att olika PCR-primers är utformade för kolonin PCR.
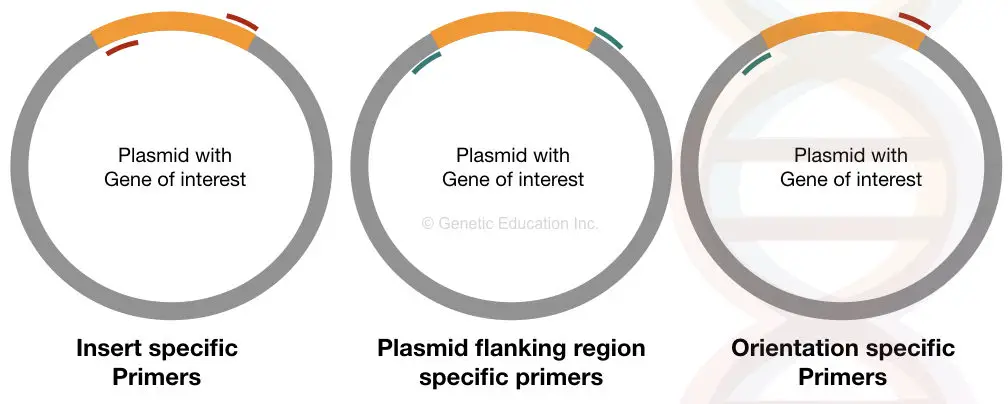
de infogade specifika primrarna binder till den specifika platsen på båda sidor av det infogade DNA av vårt intresse. Om det överförs ordentligt till plasmid, kan dessa primers binda till det annars kan det inte kunna binda.
denna primeruppsättning ger information om närvaron eller frånvaron av insatsen.
Orienteringsspecifika primers är unika primers där en primer binder inuti insatsen och en annan primer binder till plasmid-DNA-sekvensen (annan sekvens än infoga-DNA).
denna typ av primeruppsättning ger information om orienteringen av infogat DNA av vårt intresse. Om vårt insättnings-DNA inte är ordentligt ligerat i vektorn, kan primern som är specifik för den sidan av sekvensen inte binda, och vi kommer inte att få förstärkningen.
Plasmidspecifika primers är också lika viktiga som orienteringsspecifika primers. Denna uppsättning primers är utformade från den flankerande regionen av insatsen som binder till utsidan av DNA av vårt intresse.
denna uppsättning primer hjälper till att bestämma storleken på insatsen. Det expanderar andra regioner än infoga DNA.
PCR-reaktionen för att utföra kolonin PCR är som följer,
| komponent | koncentration | kvantitet |
| Master mix (Special
för kolonin PCR) |
1X | 12 |
| PCR – reaktionsbuffert
med 2 mm MgCl2* |
1X | 5 |
| framåt primer | 10pM | 1 |
| omvänd primer | 10pM | 1 |
| Supernatant | 3 | |
| vatten | 3 | |
| totalt | ——— | 25 |
förfarandet för koloni PCR:
Tja, kolonin PCR behöver inte extraherat DNA.
vi extraherar inte DNA här. Istället används flera andra metoder för att öka reaktionens känslighet.
Ok, varför extraherar vi inte DNA för plasmid-DNA?
eftersom orsaken är enkel är cellmembranet i bakteriecellen mycket slät.
vi hade redan diskuterat cellmembranet i bakteriecellen. Läs det här: olika typer av DNA-extraktionsmetoder
en bakterie innehåller mjukcellsmembran som lätt kan lyseras genom uppvärmning eller centrifugering med hög hastighet.
vi behöver inte heller bakteriens eget DNA. Den cirkulerande cirkulära plasmid är närvarande i bakteriens cytoplasma, därför krävs inte ytterligare reningssteg. Genom att bryta cellmembranet är vårt mall-DNA redo för amplifieringen.
Ok, låter snabbt gå igenom metoden för att erhålla bra plasmid-DNA.
med hjälp av den sterila plockaren, plocka flera bakteriekolonier och överför den till Eppendorf-röret.
lägg nu till te-buffert i den och blanda den väl. Du kan också använda D / W.
värm provet i det kokande vattenbadet i 20 minuter.
försiktigt vertex det.
Centrifugera provet med hög hastighet i 2 minuter.
överför supernatanten till ett annat rör och använd det som ett mall-DNA.
ett prov på 20 oC-l tillsätts i reaktionen.
ytterligare information:
varför supernatant och inte pellet?
DNA är en biomolekyl av livet. Plasmid-DNA är ännu mindre än det bakteriella nukleära DNA. Den innehåller bara flera gener på upp till 1000bp till 20 000 bp.
därför kommer det lättare plasmid-DNA genom att bara Centrifugera det ut från cellen och bosatte sig i supernatanten medan pelleten innehåller proteiner och kärn-DNA så att vi inte använder det.
kommer nu till punkten.
vår plasmid är klar för förstärkning.
i en annan metod,
använd bakteriekolonin direkt.
denna metod är en kombination av Hotstart PCR och colony PCR.
bakteriekolonierna plockas och tillsätts till PCR-reaktionsröret.
rören placeras i PCR-maskinen. Ytterligare ett uppvärmningssteg läggs till.
genom att värma det 5 till 7 minuter kommer plasmid-DNA ut från cellen.
nu förstärker de insatsspecifika primrarna DNA som vi satt in. Och de flankerande primrarna förstärker resten av DNA.
förstärkningen görs i 20 till 25 cykler. Cykelförhållandena för kolonin PCR listas nedan,
| PCR-steg | Initial denaturering | denaturering | glödgning | förlängning | slutlig förlängning |
| temperatur | 95 C | 95 C | 55-65 C | 72 C | 72 C |
| tid | 3min | 10 sek | 45 sek | 50 SEK | 5 min |
| ——- | ——- | 25 cyklar | —– | ——- |
läs den intressanta artikeln om konventionell PCR: en komplett Guide för polymeraskedjereaktionen
tips för förbättring:
använd bara några kolonier, eftersom många kolonier ökar risken för de icke-specifika bindningarna.
använd positiv kontroll och negativ kontroll.
som en positiv kontroll använde den flankerande primern även om insatsen inte är närvarande, ger PCR-reaktionen DNA-band av plasmid-DNA som indikerar att reaktionen vi förberedde är korrekt.
som en negativ kontroll, använd den otransformerade plasmid (plasmid utan insättnings-DNA), detta plasmid-DNA förstärks endast om insatsen är närvarande.
som en insats använder korta DNA-sekvenser, längre DNA-sekvenser ökar risken för icke-specifika bindningar och PCR-reaktionsfel.
använd dessutom kortare PCR-program.
den huvudsakliga tillämpningen av koloni PCR är i identifieringen av korrekt ligering och införande av infoga DNA i bakterier såväl som jästplasmid.
efter avslutad koloni-PCR-reaktion körs PCR-produkterna på 2% agarosgel. Resultaten av experimentet visas i figuren nedan,
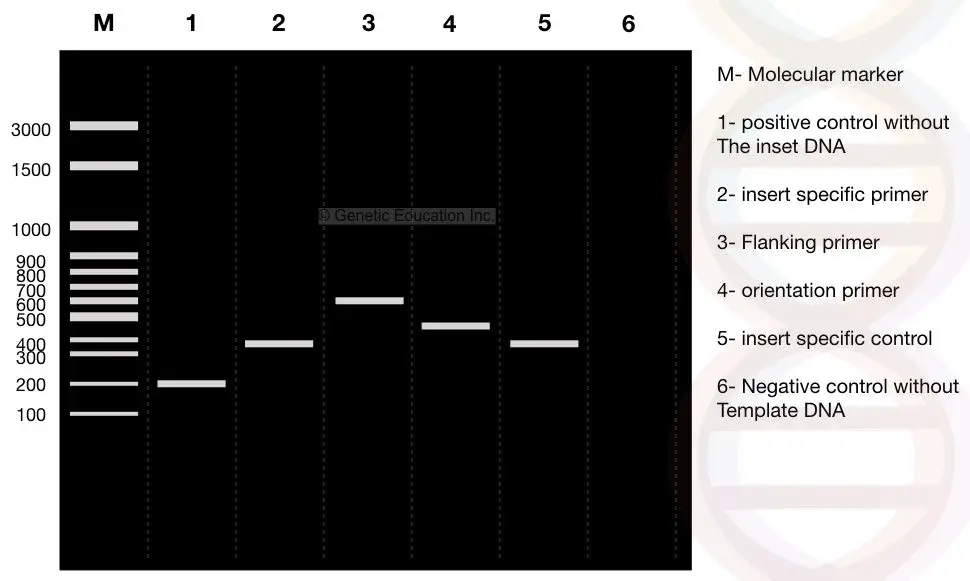
observera nu noggrant resultaten, M är 3000bp molekylär DNA-markör. Antag att DNA av vårt intresse,” infoga ” är ett 400bp-fragment som sätts in i plasmid.
se körfältet 2: 400 bp-fragmentet i vår insats.
vi designade flankerande primers 100bp bort från båda sidorna av insatsen. Om den flankerande primern förstärker DNA tillsammans med insatsen produkten är 600 bp, se körfält 3 (400 bp av infoga DNA + 200 BP flankerande region).
nu, se lane 1, är det en positiv kontroll utan insatsen eller en normal plasmid utan det transformerade DNA. Därför förstärker de flankerande primrarna endast 200 BP DNA.
se lane 1, 200BP fragment av DNA utan insats (positiv kontroll).
observera nu körfält 4. Lane 4 är resultatet av orienteringsspecifika primers. Den orienteringsspecifika primern är en kombination av insatsspecifik primer och flankerande regionspecifik primer.
en primer från Infoga DNA och en primer från den flankerande regionspecifika primern väljs för orienteringsspecifik primerförstärkning.
därför förstärks 100 bp-fragment från den flankerande regionprimeren och 400bp från infognings-DNA och 500 bp-fragment av DNA observeras i körfält 4.
Lane 5 är den insatsspecifika kontrollen som ger 400 bp DNA-fragment.
Lane 6 är den negativa kontrollen utan mallen. Genom att använda negativ kontroll kan eventuell förorening identifieras. Reaktionsröret innehåller alla ingredienser utom mallen. Så idealiskt finns inga DNA-band i denna körfält.
om ett DNA-band observeras är provet förorenat.
fördelar med koloni PCR:
- tekniken är snabb och kostnadseffektiv.
- vidare är noggrannheten och specificiteten hos tekniken högre.
- installationen är enkel precis som konventionell PCR, DNA-extraktion och plasmidrening som mödosamma steg krävs inte.
- inget behov av begränsning digestion för identifiering av infoga DNA.
- hela experimentet kan slutföras inom 90 minuter.
nackdelar med koloni PCR:
- metoden är kostnadseffektiv, snabb och pålitlig, men någon mutation i insatsen kan inte detekteras.
- dessutom kan sekvensinformationen inte erhållas av kolonin PCR. vi måste göra sekvensering för bekräftelse av DNA-transformationen.
- risken för falskt positiva resultat är hög.
Läs mer;
- vad är en multiplex PCR?
efter avslutad experiment skickas provet för sekvensering där DNA-sekvensen av vårt intresse kan bestämmas.
vi kan även göra multiplex PCR genom att kombinera både infoga specifika primers och plasmid-specifika primers.
slutsats:
även om kolonin PCR är det bästa valet för identifiering av genöverföring, är den enda kolonin PCR-tekniken inte tillräcklig för att tolka resultaten. Det kan vara möjligt att några av de mutationer som finns i insatsen, som inte kan detekteras av PCR.
för att bekräfta resultaten krävs DNA-sekvensering. Efter att ha bestämt sekvensordningen kan vi säga om vår gen av intresse sätts in korrekt eller inte.