Verwandtes Antigen-Engagement auf Parenchymzellen stimuliert CD8+ T-Zellproliferation in situ
- Verwandtes CD8+ T-Zellen werden in LN und entzündetem Gewebe gefunden
- CD8 + T-Zellen dehnen sich an der Entzündungsstelle aus
- Verwandte Interaktion mit Inseln fördert die Expansion
- Eine verwandte Interaktion mit residenten Leukozyten ist nicht erforderlich
- Verwandte Interaktion mit Parenchymzellen ist wichtig
- T-Zellen vermehren sich am Ort der Entzündung
- Verwandte Interaktion mit Parenchymzellen treibt die Proliferation an
- IL-2 ist am Ort der Entzündung wichtiger
Verwandtes CD8+ T-Zellen werden in LN und entzündetem Gewebe gefunden
In ersten Experimenten (Abb. 1) wir haben ein Modell etabliert, in dem CD8-T-Zell-Antworten auf ein parenchymales Antigen, Ovalbumin (OVA), analysiert werden konnten. OT-I-Mäuse exprimieren eine transgene TCR, die die CD8 + T-Zell-Erkennung des OVA257-264-Peptids vermittelt, das auf dem MHC-Klasse-I-Molekül H-2Kb präsentiert wird. CD8-T-Zellen wurden aus OT-I / CD45.1-Mäusen angereichert, CFSE-farbstoffmarkiert und adoptiv durch i.v. in B6 (CD45.2 +) -Wirtsmäuse übertragen. Adoptiv transferierte T-Zellen konnten durch CD45.1-Färbung (sowie CD8 und die Va2-Kette des OT-I-TCR) von Wirtszellen unterschieden werden, während CFSE-Farbstoffverdünnung verwendet wurde, um Zellen zu identifizieren, die proliferiert waren (z. B. Abb. 1a, Ergänzend Fig. 1). Parenchymales Antigen wurde durch Pfropfen von B6 eingeführt.ßOVA-Inseln (solche Inseln exprimieren Eizellen in parenchymalen β-Zellen unter dem Ratteninsulinpromotor, ergänzende Tabelle 1) unter der Nierenkapsel von Wirtsmäusen, die bereits OT-I / CD45.1 T-Zellen erhalten hatten. Alle drei Quellen (Wirt, T-Zellspender und Inselchenspender) haben einen B6-Hintergrund und exprimieren daher H-2Kb. Obwohl die Expression des OVA-Antigens auf gepfropfte β-Zellen beschränkt war, nahmen wir an, dass die Präsentation von β-Zellen abgeleiteter OVA durch nicht-parenchymale APC wie DC über Kreuzpräsentation für die LN-Priming und möglicherweise lokale T-Zell-Reaktionen erforderlich sein würde17,18.

Geteilte OT-I-Zellen (lebensfähiges CD45.1 + CD8 + Va2 + Gate) in entwässerndem Nieren-LN und Transplantat 3 oder 6 Tage nach Erhalt eines einzelnen Transplantats von 400 B6.Islova Inseln. (a) Repräsentative Durchflusszytometrie-Plots. Die Position des ungeteilten OT-I-Peaks wurde unter Verwendung einer ‘No-Antigen’-Kontrolle eines B6-Insel-Transplantats bestimmt. (b) Gesamtzahl der geteilten OT-I in Nieren-LN und Transplantat, wobei jeder Punkt eine einzelne Maus darstellt. Gepoolte Daten aus sieben unabhängigen Experimenten: n = 8 Transplantatempfänger am Tag 3 und n=14 Transplantatempfänger am Tag 6. Eines Tages ging das Transplantat aufgrund einer Fehlfunktion des Durchflusszytometers verloren. Horizontale Balken sind Mittelwerte, P-Werte wurden durch ungepaarten, zweischwänzigen T-Test mit Welchs Korrektur berechnet.
CD8 + T-Zellen dehnen sich an der Entzündungsstelle aus
Wie erwartet wurde zuerst eine starke OT-I-Reaktion im renalen LN nachgewiesen, das die Transplantationsstelle entwässert, und dies war abhängig von der Anwesenheit von OVA-Antigen (Abb. 1a, b). 3 Tage nach der Transplantation konnte geteiltes OT-I in LNs nachgewiesen werden, das das B6 entwässert.ßOVA-Insel-Transplantate (Abb. 1a) und waren reichlich vorhanden (Fig. 1b, Mittelwert=9,2 × 104). Im Gegensatz dazu konnten innerhalb von B6 100-fach weniger geteilte OT-I-Zellen nachgewiesen werden.ßOVA-Transplantate (Abb. 1a, b, Mittelwert=6,6 × 102). Die Anzahl der geteilten OT-I-Zellen erhöhte sich an der Transplantationsstelle von Tag 3 bis Tag 6 um das 300-fache (Abb. 1b, Mittelwert=6,6 × 102 an Tag 3 bis 2,1 × 105 an Tag 6, P< 0,0001, ungepaarter zweischwänziger T-Test mit Welch’scher Korrektur), während es keinen Anstieg der LN gab (Abb. 1b). Die OT-I-Antwort in B6.ßOVA-Transplantate konnten durch Infiltration von OT-I-Zellen erklärt werden, die sich im LN vermehrt hatten. Die CFSE-Profile unterschieden sich jedoch zwischen den Transplantat- und LN-Stellen, da die OT-I-Zellen in den Transplantaten am Tag 6 stärker geteilt waren als die im LN (Abb. 1a). Es gibt mindestens zwei mögliche Erklärungen für diesen Unterschied. Nur Zellen, die sich viele Male geteilt hatten, infiltrierten das Transplantat. Alternativ können sich die Zellen, die das Transplantat erreichen, schneller teilen, möglicherweise aufgrund der Fülle an verfügbarem Antigen. Der Anstieg der absoluten Zellzahlen im Transplantat im Vergleich zu LN am Tag 6 veranlasste uns, diese letztere Erklärung zu untersuchen.
Verwandte Interaktion mit Inseln fördert die Expansion
Um den möglichen Beitrag von verwandtem MHC im Transplantat zur lokalen Expansion zu bestimmen, verwendeten wir von bm1 abgeleitete Inseln.ßOVA-Mäuse (ergänzende Tabelle 1). In bm1.Bei Mäusen ist das H-2Kbm1–Molekül aufgrund von drei Mutationen zu H-2Kb nicht in der Lage, das OVA257-264-Peptid zu präsentieren (Ref. 19). Ein Vergleich der Antworten auf B6.ßOVA und bm1.ßOVA-Inselchen-Transplantate zeigten, dass trotz ähnlicher OT-I-Reaktionen im drainierenden renalen LN die Expansion von OT-I in bm1 um das Sechsfache reduziert wurde.ßOVA im Vergleich zu B6.ßOVA-Transplantate (Mittelwert=4.7 × 104 im Vergleich zu 2,6 × 105 geteiltem OT-I; P = 0,0153 ungepaarter zweischwänziger T-Test mit Welchs Korrektur; Abb. 2a). Diese weniger effiziente Expansion von OT-I-Zellen infiltriert bm1.ßOVA-Transplantate deuteten darauf hin, dass verwandte Wechselwirkungen mit transplantierten Inselzellen zur lokalen T-Zell-Expansion beitrugen.

Durchflusszytometrische Analyse von OT-I-Zellen (lebensfähiges CD45.1 + CD8 + Va2 + Gate) 6 Tage nach Transplantation. (a) Insgesamt geteiltes OT-I in der drainierenden Nieren-LN und Transplantat nach Erhalt eines einzelnen Transplantats von 400 B6.ßOVA oder bm1.Islova Inseln. Daten für B6.ßOVA-transplantierte Mäuse sind eine Untergruppe der in Abb. 1b. Jeder Punkt repräsentiert eine individuelle Maus. Gepoolte Daten aus zwei unabhängigen Experimenten werden in jedem Panel angezeigt: n = 5 Empfänger von B6.ßOVA-Transplantate und n = 6 Empfänger von bm1.ßOVA-Transplantate. Horizontale Balken sind Mittelwerte, P-Werte wurden durch ungepaarten, zweischwänzigen T-Test mit Welchs Korrektur berechnet. (b) Schematische Darstellung eines bipolaren Transplantatmodells, bei dem Transplantate von 200 Inseln an gegenüberliegenden Polen derselben Niere platziert werden und sich eine gemeinsame drainierende Nieren-LN teilen. Gesamt geteilt OT-I in (c) B6.kOVA und KbKO.ßOVA bipolare Transplantate und (d) B6.ßOVA- und B6-Bipolartransplantate (n = 5 Empfängermäuse aus zwei unabhängigen Experimenten in jeweils c und d) Daten für dieselbe Maus sind durch gestrichelte Linien verbunden: P-Werte wurden durch Verhältnispaar-t-Test berechnet.
Um jeglichen Beitrag von H-2Kbm1 Alloantigen zu eliminieren, haben wir KbKO generiert.ßOVA-Mäuse, die EIZELLEN-Antigen in Insel-Beta-Zellen exprimieren, aber kein Alloantigen oder H-2Kb haben (ergänzende Tabelle 1). Wir verwendeten dann ein ‘bipolares Transplantatmodell’, um die Reaktionen auf B6 zu vergleichen.kOVA und KbKO.ßOVA-Insel-Transplantate, die an gegenüberliegenden Polen derselben Niere in einer B6-Wirtsmaus platziert wurden, so dass Transplantat-infiltrierende T-Zellen von T-Zellen abgeleitet wurden, die in derselben LN grundiert waren (Abb. 2b). In B6 waren 10-100-fach mehr T-Zellen vorhanden.ßOVA als KbKO.ßOVA-Transplantate (Abb. 2c). Unter Verwendung des für einzelne Mäuse berechneten Verhältnisses von geteiltem OT-I an entgegengesetzten Polen der Niere leiteten wir ein relatives Ansprechverhältnis (RRR) ab. Die RRR zeigte, dass die lokale T-Zell-Expansion 26-fach größer war, wenn eine verwandte Interaktion mit Transplantatzellen auftrat (RRR = 26,4 ± 14,1 in B6.In: KbKO.ßOVA-Transplantate, P=0,0025, Verhältnis gepaarter t-Test, Abb. 2c).
Wir verglichen auch die Reaktionen auf Vitamin B6.ßOVA- und B6-Transplantate (kein Antigen) (Abb. 2d). Innerhalb von B6-Transplantaten konnten nur sehr wenige OT-I nachgewiesen werden (Abb. 2d) und wir halten es für wahrscheinlich, dass viele davon zirkulierendes OT-I waren, das aus Blutkontamination stammte. Daher führt eine unspezifische Entzündung, die mit der Transplantation von Transplantaten verbunden ist, denen Antigen fehlt, nicht zu einer effizienten T-Zell-Expansion innerhalb des entzündeten Gewebes. Im Gegensatz dazu die Antwort auf B6.ßOVA Grafts war wieder sehr potent und mehr als 900-fach größer als die der B6-Grafts (RRR=950±252 für B6.ßOVA: B6-Transplantate, P< 0,0001, Verhältnis gepaarter t-Test, Abb. 2d).
Zusammen zeigten diese Experimente, dass die CD8-T-Zell-Expansion innerhalb des entzündeten Zielgewebes durch lokale Antigenpräsentation signifikant gefördert wurde. Dies schließt nicht notwendigerweise andere Beiträge zur T-Zellexpansion aus, beispielsweise durch Kreuzpräsentation von Wirtszellen im Transplantat. Wir wissen nur, dass die verwandte Interaktion zwischen T-Zellen und Inselzellen zu einer erheblichen T-Zellexpansion führt.
Eine verwandte Interaktion mit residenten Leukozyten ist nicht erforderlich
Inseln sind komplexe Zellcluster, zu denen β-Zellen, Endothelzellen und inselresidente Leukozyten (IRL) gehören. Daher versuchten wir als nächstes zu klären, welche Inselzellen ein Antigen für infiltrierende T-Zellen präsentierten, um die T-Zell-Expansion voranzutreiben. Der offensichtlichste Kandidat wäre IRL. Diese CD45 + -Zellen wurden verschiedentlich als DC oder Makrophagen definiert, exprimieren CD11c und F4 / 80 und es wurde gezeigt, dass sie Antigene verarbeiten und präsentieren20,21,22,23. Wir untersuchten daher die Rolle von Spender-IRL bei der lokalen CD8-T-Zell-Expansion. B6.ßOVA-Mäuse wurden mit CD11c.DTR gekreuzt.GFP-Mäuse, um CD11c.DTR zu erhalten.GFP.ßOVA-Mäuse, deren β-Zellen Eizellen exprimieren und deren CD11c + -Zellen durch Diphtherietoxin (DT) -Injektion abgetragen werden könnten8. Wir haben zuerst von FACS getestet, dass Islets isoliert von CD11c.DTR.GFP-Mäuse, die mit DT behandelt wurden, waren an CD11c + -Zellen abgereichert (Abb. 3a, b). CD11c+ IRL in unbehandelten Kontrollmäusen wurden durch Färbung für CD45 und CD11c sowie deren Expression des GFP-Reporters identifiziert und durch DT-Behandlung deutlich abgereichert (Abb. 3a, b, P=0,0002, ungepaarter zweischwänziger T-Test mit Welch-Korrektur). Wir bestätigten auch, dass das CD11c + IRL F4 / 80 und H-2 Kb MHC Klasse I coexprimierte (Ergänzende Abb. 2a) und folglich F4/80+-Zellen wurden auch von den Inseln der behandelten Mäuse abgereichert (Ergänzende Fig. 2b). In: CD11c.DTR.GFP.ßOVA-Inseln, die aus unbehandelten und DT-behandelten Mäusen isoliert wurden, wurden an gegenüberliegenden Polen derselben Niere transplantiert. Die OT-I-Zahl war zwischen den Transplantaten ähnlich, was darauf hindeutet, dass die IRL-Depletion keinen Einfluss auf die CD8 + -T-Zellexpansion an der Transplantationsstelle hatte (Abb. 3c). Um zu bestätigen, dass IRL für die lokale CD8-T-Zell-Expansion nicht wichtig waren, führten wir eine zweite Reihe von Experimenten durch. KbKO.ßOVA-Mäuse wurden bestrahlt und entweder mit KbKO- oder B6-Knochenmark (BM) rekonstituiert, um eine Quelle von ßOVA-Inseln zu erzeugen, in denen die H-2Kb-Expression in allen Zellen fehlte oder selektiv zu IRL wiederhergestellt wurde (Abb. dreidimensional). Der Vergleich solcher Inseln im bipolaren Transplantatmodell zeigte ähnliche Niveaus der OT-I-Zellexpansion in beiden Transplantaten (Abb. 3e). Daher sind IRL keine Haupttreiber der lokalen CD8-T-Zell-Expansion.

Durchflusszytometrie-Analyse zeigt Verarmung von CD11c + IRL in CD11c.DTR.GFP-Mäuse mit DT behandelt: (a) Repräsentative Diagramme, die das Gating von CD11c + IRL in Inseln unbehandelter Kontrollmäuse und deren Depletion am Tag nach einer einzelnen DT-Behandlung zeigen, und (b) Aufzählung von CD11c + IRL in unbehandelten und DT-behandelten Mäusen. Jeder Punkt stellt eine einzelne Inselpräparation dar, die gepoolte Inseln von 1 bis 8 Mäusen, n = 5 unbehandelte Inselpräparate und 6 DT behandelte Inselpräparate aus vier unabhängigen Experimenten enthält. P-Wert berechnet durch ungepaarten, zweischwänzigen T-Test mit Welchs Korrektur. (c) Insgesamt geteiltes OT-I 6 Tage nach dem bipolaren Transplantat von Inseln, die aus CD11c.DTR erhalten wurden.GFP.ßOVA-Mäuse, die unbehandelt oder mit DT behandelt wurden (n = 6 Empfängermäuse aus zwei unabhängigen Experimenten). Daten für die gleiche Maus sind durch gestrichelte Linien verbunden; P-Werte durch Verhältnis gepaart T-Test berechnet. (d) Repräsentative Diagramme, die das Fehlen oder Vorhandensein einer H-2Kb-Expression auf CD11c + IRL von KbKO-Mäusen zeigen, die mit KbKO bzw. B6 BM rekonstituiert wurden. Pregated auf lebensfähigen Zellen. (e) Insgesamt geteiltes OT-I 6 Tage nach dem bipolaren Transplantat von Inseln, die von chimären Mäusen erhalten wurden (n = 3 Empfängermäuse aus einem einzigen Experiment). Daten für dieselbe Maus sind durch gestrichelte Linien verbunden; P-Werte berechnet durch Verhältnis gepaart t-Test.
Verwandte Interaktion mit Parenchymzellen ist wichtig
B6.RIP-Kb-Mäuse exprimieren transgen H-2Kb in β-Zellen unter der Kontrolle des Ratteninsulinpromoters24. Durch Kreuzung dieser Mäuse zu KbKO.ßOVA: Wir haben KbKO generiert.kOVA.ßKb-Mäuse, bei denen die H-2Kb-Expression auf β-Zellen beschränkt war (ergänzende Tabelle 1). Die Expression von H-2Kb auf β-Zellen wurde durch FACS-Analyse von Inseln bestätigt (Abb. 4a). Wir untersuchten hämatopoetische Inselzellen (CD45 +) und Endothelzellen (CD31 +) und zeigten, dass H-2Kb in beiden KbKO nicht auf diesen Zellen exprimiert wurde.ßOVA oder KbKO.kOVA.ßKb-Mäuse im Vergleich zur starken Expression in B6-Mäusen (Abb. 4a). Die verbleibenden CD45-CD31- Zellen sind autofluoreszenzpositiv und in endokrinen Zellen angereichert. FACS-Analyse von Inseln von KbKO.kOVA.ßKb-Mäuse zeigten eine H-2Kb-Expression innerhalb der β-Zell-angereicherten autofluoreszenten Population in ähnlichen Konzentrationen wie auf B6-Inseln (Abb. 4a). Ein Vergleich im bipolaren Transplantatmodell zeigte, dass die Expansion von OT-I 14-fach größer war, wenn verwandtes Antigen auf β-Zellen exprimiert wurde (RRR = 14,0 ± 4,1 für KB).kOVA.ßKb: KbKO.ßOVA-Transplantate, P=0,0008, Verhältnis gepaarter t-Test, Abb. 4b).

( a) Durchflusszytometrie-Plots (gated auf lebensfähigen Zellen), die eine selektive Wiederherstellung der H-2Kb-Expression auf Parenchymzellen zeigen. Histogramme repräsentieren Inseln von KbKO (schattiert), B6 (gestrichelt) oder KbKO.ßKb (fett) Mäuse. (b) Insgesamt geteiltes OT-I 6 Tage nach dem bipolaren Transplantat von KbKO.kOVA und KbKO. kOVA.ßKb. inseln (n = 6 Empfängermäuse aus drei unabhängigen Experimenten). Daten für die gleiche Maus sind durch gestrichelte Linien verbunden; P-Werte durch Verhältnis gepaart T-Test berechnet.
T-Zellen vermehren sich am Ort der Entzündung
Unsere obigen Befunde zeigen, dass es eine lokale Proliferation an der Zielstelle gab. Um aktiv proliferierende Zellen nachzuweisen, kreuzten wir OT-I / CD45.1-Mäuse mit FucciRG-Mäusen, um FucciRG / OT-I / CD45 zu erzeugen.1 mäuse (abgekürzt FucciOT-I). In solchen Mäusen fluoreszieren Zellen rot (FucciR) während G0 / G1 und grün (FucciG) während S / G2 / M Zellzyklusphasen25,26. Der allmähliche Abbau und die Akkumulation von FucciR− und FUCIG−Reportern während des Übergangs zwischen den Zyklusphasen ermöglicht weitere Unterscheidungen: intensivere FucciR-Expression in ruhenden G0-versus zyklischen G1-Zellen, doppelt negative FucciR-G-Zellen in sehr frühen G1- und schwach doppelt positive FucciR + G + -Zellen in G1 / S (refs 26, 27). Ruhende FucciOT-I-Zellen von ungepfropften Mäusen waren FucciG- (Abb. 5a, obere Platte, ungepfropft). Um Interferenzen mit den Fucci-Farbstoffen zu vermeiden, haben wir CFSE durch CTV ersetzt. Bei Mäusen, die B6 erhalten hatten.ßOVA-Transplantate, Analyse der CTV-Verdünnung zeigten, dass geteilte FucciOT-I im drainierenden renalen LN vorhanden waren und einige davon FucciG + waren, was auf eine aktive Zellteilung hindeutet (Abb. 5a, obere Platte, (LN). An der Transplantationsstelle entdeckten wir FucciOT-I, das viele Divisionen durchlaufen hatte (CTV nicht mehr nachweisbar), und viele davon waren FUCCIGS, die die anhaltende Proliferation unterstützten (Abb. 5a, obere Platte, frisches Transplantat). Vergleich des Anteils von FucciG+ -Zellen innerhalb der geteilten OT-I-Population (Abb. 5c) zeigte an, dass die anhaltende Proliferation innerhalb frischer Transplantate (26,8 ± 8,8% FucciG +) die Proliferation entweder im drainierenden Nieren-LN (7,3 ± 1,6%, P = 0,008, ungepaarter Zwei-Schwanz-T-Test mit Welch-Korrektur) oder nicht-drainierenden Nieren-LN (2,1 ± 2,1%, P = 0,003, ungepaarter Zwei-Schwanz-T-Test mit Welch-Korrektur) übertraf. Tatsächlich zeigte die Untersuchung sowohl der FucciG- als auch der FucciR-Expression, dass sich die meisten Transplantat-infiltrierenden OT-I aktiv teilten, dh sehr wenige Zellen zeigten eine hohe Expression von FucciR, die für ruhende Zellen im LN von ungepfropften Mäusen charakteristisch war (Abb. 5a, untere Platten). Obwohl wir vermuteten, dass diese Proliferation an der Entzündungsstelle in situ erzeugt wurde, konnten wir die Möglichkeit nicht vollständig ausschließen, dass dies einfach die jüngste Ankunft proliferierender Zellen widerspiegelte. Um dies zu klären, haben wir die bipolaren Transplantate von B6 geerntet.ßOVA-Inseln, um ein Transplantat unmittelbar nach der Exzision zu analysieren und das andere Transplantat 1 Tag lang zu kultivieren (Abb. 5a). Während die Anzahl der OT-I über den Kulturzeitraum nicht anstieg (Abb. 5b), die vermutlich den Zelltod unter suboptimalen ex-vivo-Bedingungen widerspiegelten, wurden weiterhin viele FucciG+ OT-I-Zellen nachgewiesen (14,2± 4,2% FucciG+, Abb. 5c). Das Profil des kultivierten Transplantats ohne mögliche Rekrutierung für einen Tag würde darauf hindeuten, dass eine hohe De-Novo-Proliferation im Transplantat vorliegt.

( a) Schematische und repräsentative Durchflusszytometriepläne (gated auf lebensfähigen CD45.1 + CD8 + Va2 + Lymphozyten), die die Reaktion von FucciOT-I-Zellen in renalem LNs oder bipolarem B6 zeigen.ßOVA-Transplantate. LNs und das Transplantat von einem Pol wurden sofort untersucht (6 Tage nach dem Transplantat frisch), während das Transplantat vom gegenüberliegenden Pol vor der Analyse 1 Tag lang kultiviert wurde. LN aus einer ungepfropften Maus wurde eingeschlossen, um das Fehlen von Teilung und FucciG-Expression (obere Tafel) und das Vorherrschen von FucciR-Hochzellen (untere Tafel) in ruhendem FucciOT-I zu zeigen. (b) Insgesamt geteiltes FucciOT-I in frischen und kultivierten Transplantaten. Mittelwert + s.d., n = 5, P-Werte berechnet durch Zwei-tailed Verhältnis gepaart t-Test. (c) %FucciG+/ OT-I in frischem, nicht drainierendem und transplantatdrainierendem Nieren-LN sowie frischen und kultivierten Transplantaten. Mittelwert + s.d., n = 5 mit Ausnahme von nicht entwässerndem LN, für das n = 4 aufgrund des Verlusts eines LN während der Verarbeitung. P-Werte wurden durch zweischwänzigen ungepaarten T-Test mit Welch-Korrektur berechnet. Die Daten stammen aus zwei unabhängigen Experimenten.
Verwandte Interaktion mit Parenchymzellen treibt die Proliferation an
Als nächstes nutzten wir das FucciOT-I-Modell, um die Rolle eines anderen potenziellen lokalen T-Zell-Treiberproliferation im Transplantat, Host-abgeleitete APC wie entzündliche DC zu bewerten. Um jeglichen Beitrag von Host APC zu eliminieren, haben wir zuerst einen KbKO-Hintergrund abgeleitet. Als KbKO-Mäuse OT-I-Zellen ablehnten, schufen wir KbKO BM in B6-Chimären, um sie als Wirte zu verwenden; so fehlten den hämatopoetischen Zellen H-2Kb, waren aber für OT-I-Zellen permissiv. Diese Chimären erhielten FucciOT-I-T-Zellen und bipolare Transplantate von KbKO.ßOVA-Inseln (ohne H-2Kb-Expression und damit ohne die Fähigkeit, OVA-Antigen zu präsentieren) und KbKO.kOVA.ßKb-Inseln (sowohl H-2Kb als auch OVA-Antigen waren auf β-Zellen beschränkt). Da den Chimären H-2Kb-positives APC fehlte, war es notwendig, OVA257-264-Peptid-beschichtete Milzzellen zu verabreichen, um die OT-I-Reaktion zu initiieren. Der Erfolg dieses Primings wurde durch CTV-Verdünnung in FucciOT-I-Zellen im renalen LN gezeigt, obwohl diese zum Zeitpunkt der Ernte FucciG− waren und sich nicht aktiv zu teilen schienen (0,1 ± 0,0% FucciG +, Abb. 6a, d). Sehr wenige OT-I infiltriert die KbKO.ßOVA-Transplantate wurden aber innerhalb von KbKO deutlich erweitert.kOVA.ßKb-Transplantate (RRR von 61,4 ± 26,6 für KbKO.kOVA.ßKb: KbKO.ßOVA, Abb. 6b, P=0,0008, zweischwänziges Verhältnis (t-Test). Somit war selbst in Abwesenheit von verwandtem Antigen auf dem Wirt-APC ein verwandtes Antigen auf parenchymalen β-Zellen ausreichend, um die CD8-T-Zell-Expansion an der Transplantationsstelle voranzutreiben. Die wenigen FucciOT-I T-Zellen in KbKO.ßOVA-Transplantate ähnelten denen im LN sowohl hinsichtlich ihres ineffizienten Fortschreitens zur hochgeteilten Fraktion (Abb. 6a, c, 7,5±0,9% stark geteilt in LN und 19,3±3,3% stark geteilt in KbKO.ßOVA-Transplantate) und fehlende Fuccigexpression (Abb. 6a, d, 0,1±0,0% in LN und 0,1±0,1% in KbKO.ßOVA-Transplantate), was darauf hindeutet, dass an der Transplantatstelle in Abwesenheit eines verwandten Antigens eine geringe OT-I-Proliferation auftrat. Im Gegensatz dazu ist die OT-I innerhalb KbKO.kOVA.ßKb-Transplantate waren überwiegend hochgeteilt (92,3±1,0%, Abb. 6a,c) und einige davon waren fucciginal und somit aktiv proliferierend (Fig. 6a, d, 5,0±1,2% FucciG+). Daher konnte die Präsentation verwandter Antigene durch inselparenchymale β-Zellen die De-novo-Proliferation von FucciOT-I in situ vorantreiben.

FucciOT-I-Reaktion auf Transplantate in KbKO BM in B6-Wirtsmäuse, bei denen hämatopoetische Wirtszellen keine H-2Kb-Expression aufweisen. Transplantierte Mäuse erhielten am Tag der Transplantation peptidbeschichtete Milzzellen, um das OT-I-Priming zu initiieren. (a) Repräsentative Durchflusszytometrie-Plots (gated auf lebensfähigen CD45.1 + CD8 + Va2 + Lymphozyten). Obere Tafel zeigt fehlende Teilung und Fuccigexpression in ruhendem OT-I in LN einer Maus, die weder gepfropft noch grundiert war. Die unteren drei Panels zeigen Antworten in einer bipolar gepfropften und grundierten Maus: Drainage, LN, KbKO.kOVA und KbKO.kOVA.ßKb-Transplantate. Geteilte Zellen in gepfropften Mäusen wurden in zwei Sektoren unterteilt, wobei die hoch geteilten Zellen in den Sektor fielen, in dem CTV über die Nachweisgrenze hinaus verdünnt wurde. (b) Gesamt geteilt FucciOT-I in KbKO.kOVA und KbKO.kOVA.ßKb bipolare Transplantate, P-Werte berechnet durch Zwei-tailed Verhältnis gepaart t-Test. (c) %highly divided und (d) % FucciG+ OT-I in drainierenden renalen LN und Transplantaten von bipolar transplantierten Mäusen. P-Werte wurden durch Zwei-tailed gepaart t-Test berechnet. Ergebnisse für einzelne Mäuse sind gestrichelt verbunden, n = 6 Empfängermäuse aus zwei unabhängigen Experimenten.
IL-2 ist am Ort der Entzündung wichtiger
Wir zeigen, dass die IL-2Ra-Expression für die CD8 + -T-Zellproliferation und -akkumulation im peripheren Parenchym (Inselchen) wichtiger war als an der Stelle des Primings im drainierenden LN (Abb. 7a). Zusätzlich analysierten wir die Reaktion an einer zweiten Stelle, die von der Stelle der Grundierung entfernt ist, dh nicht entwässerndes LN. CTV-markierte CD8+ T-Zellen aus OT-I.IL-2RaKO (IL−2Ra-CD45.2+) und OT-I/Ly5.1 (IL-2Ra+, CD45.1+CD45.2+) Mäusen wurden in B6.CD45.1 Wirtsmäuse (CD45.1+) vor Erhalt eines einzelnen Transplantats von B6.Islova Inseln. Die unterschiedlichen CD45-Allelsignaturen jeder der übertragenen T-Zell-Populationen (in Kombination mit der Färbung für CD8 und Va2) ermöglichten es uns, das Verhältnis von geteiltem WT: IL-2RaKO OT-I zu quantifizieren und zu vergleichen (Abb. 7a, Ergänzend Fig. 3). IL-2Ra WT übertraf IL-2RA KO OT-I an der Transplantationsstelle deutlich im Vergleich zu drainierenden (P = 0,025, zweischwänziger gepaarter T-Test) oder nicht drainierenden (P = 0,044, zweischwänziger gepaarter T-Test) LN. Dies steht im Einklang mit einer erhöhten Abhängigkeit von CD8 + T-Zellen von IL-2 zum Zeitpunkt der sekundären Begegnung mit Antigen an der Entzündungsstelle im Vergleich zum anfänglichen Priming im drainierenden LN.
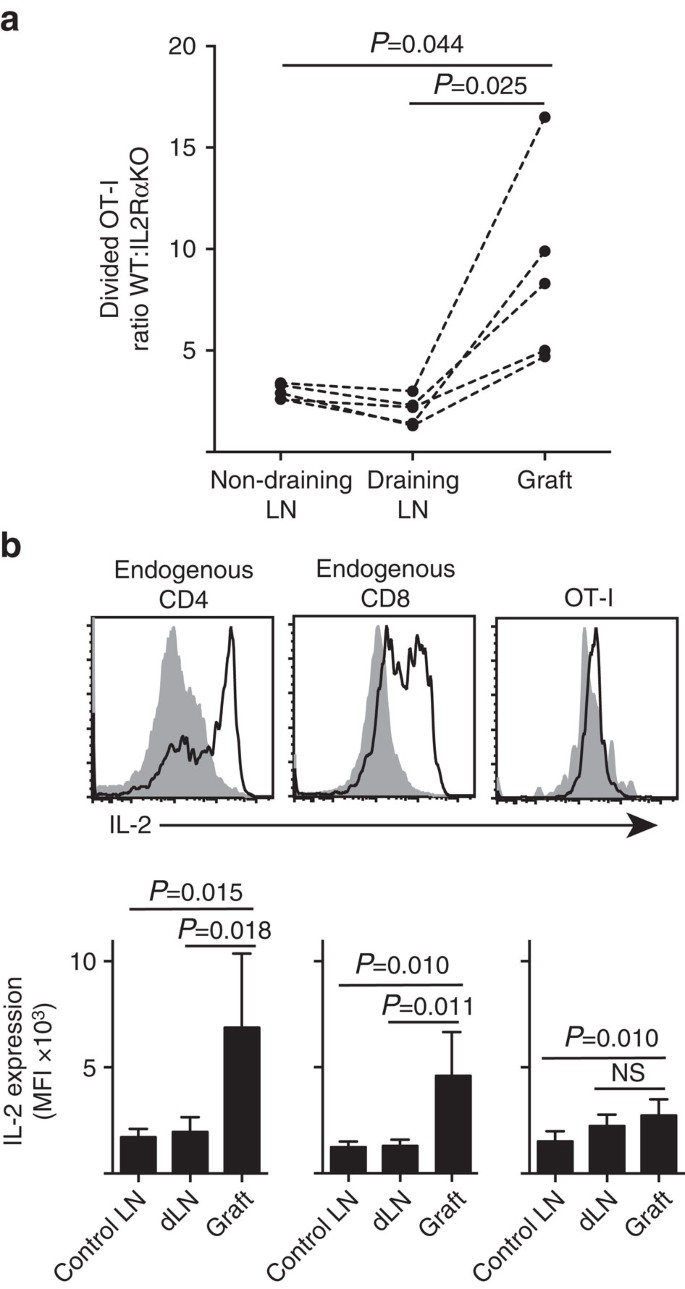
( a) Verhältnis von geteilten IL-2Ra WT: IL-2Ra KO OT-I-Zellen, die aus B6 gewonnen wurden.ßOVA-Inselchen-Transplantat, drainierende renale LN und nicht drainierende inguinale LN nach Co-Transfer (jeweils 106) in B6.CD45.1-Wirtsmäuse. Die Verhältnisse wurden für einzelne Organe mit Ergebnissen für einzelne Mäuse berechnet, die durch gestrichelte Linien verbunden waren, und durch einen zweischwänzigen gepaarten T-Test verglichen. Ergebnisse für n = 5 Empfängermäuse und repräsentativ für drei unabhängige Experimente. (b) IL-2-Expression in endogenen CD4 + – und CD8 + -Zellen und übertragenen OT-I-Zellen in B6-Empfängern von B6.pOVA-Insel-Transplantate. Obere Panels zeigen repräsentative Durchflusszytometrie-Plots für Transplantat drainierende renale LN (durchgezogen grau) und Transplantat (schwarze Linie). Die unteren Panels fassen die mittlere Fluoreszenzintensität (MFI) der IL-2-Expression für Nieren-LNs aus ungepfropften (Kontroll-LN) sowie Transplantat- und Drainage-Nieren-LN (dLN) von transplantierten Mäusen zusammen. Ergebnisse gezeigt als Mittelwert + s.d., n = 6 gepoolt aus zwei unabhängigen Experimenten und verglichen durch zweischwänzigen ungepaarten t-Test mit Welch’s Korrektur.
Die erhöhte Abhängigkeit von IL-2 für die CD8 + T-Zell-Proliferation an der Entzündungsstelle ergab eine Notwendigkeit für die lokale IL-2-Produktion. Daher untersuchten wir das Potential verschiedener T-Zellen (endogene Wirts-abgeleitete CD4+ und CD8+ sowie transferierte OT-I CD8+ T-Zellen) für die Fähigkeit, IL-2 zu produzieren (Abb. 7b). Zellsuspensionen, die aus Transplantaten oder LN hergestellt wurden, wurden kurz (4 h) mit PMA und Ionomycin restimuliert, bevor sie auf Expression von intrazellulärem IL-2 angefärbt wurden. Die Untersuchung von endogenen, vom Wirt abgeleiteten CD4 + – und CD8 + -T-Zellen lieferte überzeugende Beweise für die IL-2-Produktion an der Stelle der Transplantatentzündung mit einem deutlichen Anstieg des MFI der IL-2-Färbung im Vergleich zum drainierenden oder nicht drainierenden LN. IL-2-Spiegel in OT-I CD8 + T-Zellen an der Entzündungsstelle waren mäßig erhöht gegenüber denen in der nicht-drainierenden LN, unterschieden sich jedoch nicht signifikant von denen in der drainierenden LN. Eine Interpretation dieser Daten ist, dass die verwandte Interaktion von OT-I mit Parenchymzellen eine schnelle Proliferation, aber eine schlechte IL-2-Produktion induziert, so dass die OT-I von parakrinem IL-2 abhängig sind, das aus endogenen CD4 + – und CD8 + -T-Zellen in der lokalen Transplantatumgebung stammt. Ein zusätzliches Experiment zeigte jedoch, dass exogenes IL-2 in Abwesenheit von parenchymalem Antigen die OT-I CD8 + -Zellexpansion nicht antreiben konnte. IL-2 (rekombinantes hIL-2, 25.000 IE) wurde intraperitoneal an B6-Mäuse verabreicht, die bipolare Transplantate von B6 erhielten.ßOVA und B6 Inseln. Der Vergleich der OT-I-Erholung in Organen, die von IL-2- oder vehikelbehandelten Mäusen am Tag 6 nach der Transplantation gewonnen wurden, zeigte keinen signifikanten Anstieg der Akkumulation von geteilten OT-I-Zellen an zwei Stellen, denen parenchymales Antigen fehlt, nämlich B6-Inselchen-Transplantate (3 ± 3 in Vehikel behandelt im Vergleich zu 49 ± 64 in IL-2 behandelten Mäusen, P = 0.342) und nicht drainierende inguinale LN (1.648 + 633 bei behandelten Mäusen im Vergleich zu 1.660 + 1.023 bei mit IL-2 behandelten Mäusen, P = 0,987, Mittelwert ± s.d., n = 3, zweischwänziger ungepaarter T-Test mit Welch-Korrektur).