Was ist Computersystemvalidierung und wie mache ich das richtig?

Der Prozess der Softwarevalidierung stellt sicher, dass das System seinem Verwendungszweck entspricht und ordnungsgemäß funktioniert. Die Computersystemvalidierung (CSV) für die Laborinformatik ist von wesentlicher Bedeutung, da regulierte Unternehmen die Sicherheit ihrer Produkte für die Verbraucher gewährleisten müssen, und ihre Laborinformatiksysteme (LIMS, ELN, CDS) sind ein wesentlicher Bestandteil davon. Aufgrund ihrer Bedeutung wird die Validierung in der Regel als verwirrend und schwierig bei der korrekten Ausführung angesehen. Natürlich ist es möglich, es richtig zu machen, und CSols hat Beweise. In fast 30 Jahren haben wir noch nie von einem unserer Kunden gehört, der ein FDA 483-Formular erhalten hat.
Validierung ist Teil des Lebenszyklus der Softwareentwicklung. In diesem Blog werden wir überprüfen, was das bedeutet und wie es zu tun ist, so dass Ihr System in einem regulatorischen Audit verteidigt werden kann.
Grundlagen der Computersystemvalidierung
Keine Diskussion über die Validierung von Computersystemen ist vollständig ohne einen Überblick über die diesbezüglichen Rechtsvorschriften. In den Vereinigten Staaten reguliert die Food and Drug Administration (FDA) bestimmte Branchen, die sich direkt auf die Gesundheit der Verbraucher auswirken, einschließlich Pharmazeutika, Kosmetika sowie Lebensmittel und Getränke. Diese Branchen haben eine zusätzliche Verantwortung, um sicherzustellen, dass ihre Produkte sicher sind und ihre Daten sicher sind. Die einschlägigen Rechtsvorschriften, die sich mit Aspekten der Validierung von Computersystemen in den Vereinigten Staaten befassen, stammen aus dem Code of Federal Regulations (CFR), insbesondere 21 CFR Part 11 (Teil 11), der sich mit elektronischen Aufzeichnungen und Signaturen befasst. Ähnliche Regierungsbehörden und Vorschriften gelten auch in anderen Ländern.
Teil 11 schreibt vor, dass elektronische Aufzeichnungen und Unterschriften als genau, zuverlässig, leicht abrufbar und sicher angesehen werden müssen, um Papieraufzeichnungen und handschriftliche Unterschriften rechtlich zu ersetzen. Die Validierung Ihres Computersystems ist das primäre Mittel, um festzustellen, ob elektronische Aufzeichnungen und Signaturen auf diese Weise verwendet werden können.
Der Validierungsprozess
Die Validierung kann während des Lebenszyklus eines Computersystems viele Formen annehmen, je nachdem, ob es sich um eine neue Implementierung oder ein Upgrade eines vorhandenen Systems handelt. Bei neuen Systemen, von denen der Benutzer hofft, dass sie ein aktuelles Problem lösen können, erfolgt die Validierung von Grund auf. Für ein bestehendes System, das ein Upgrade benötigt oder den Umfang seiner beabsichtigten Verwendung erweitert, besteht die Notwendigkeit, das System in einem validierten Zustand zu halten, indem die neuen Funktionen getestet werden, bevor sie in die Produktion freigegeben werden. Der Validierungsprozess endet, wenn ein System außer Betrieb genommen wird und seine Daten erfolgreich in ein neues System migriert oder archiviert werden. Die folgende Abbildung zeigt, wie die Validierung den Projektlebenszyklus unterstützt.

Der Validierungs-Masterplan
Ihr Validierungs-Masterplan führt Sie durch den Validierungsprozess und wird zu einer Art Check-off-Liste, um sicherzustellen, dass alles so abläuft, wie es sollte. Sobald Sie den Ist-Zustand Ihres Systems bewertet haben, umfasst der Validierungs-Masterplan alle anderen Schritte, die Sie unternehmen, um sicherzustellen, dass Ihr System in seinem aktuellen Zustand validiert und für den beabsichtigten Gebrauch geeignet ist.

Der Validierungsmasterplan sollte die Erfassung von Anforderungen, eine funktionale Risikobewertung, eine Trace-Matrix, IQ OQ PQ-Protokolle und -Tests sowie Änderungskontrollverfahren mit regelmäßigen Überprüfungen berücksichtigen. Jeder Teil des Validierungsmasterplans wird in einer definierten Reihenfolge ausgeführt. Ihre Anforderungen sollten vollständig sein und die Risikobewertung durchgeführt werden, bevor Sie mit der Entwicklung der Trace-Matrix und den anschließenden Tests fortfahren. Auf diese Weise minimieren Sie das Risiko, spät im Prozess neue Testfälle entwickeln zu müssen.
Die Beziehung zwischen Anforderungserfassung und Qualifikationstests
Es ist wichtig sicherzustellen, dass Ihre Anforderungen und Spezifikationen gut definiert und genehmigt sind, bevor Sie das Computersystem validieren. Das Validierungs-V-Modell wird häufig verwendet, um die Beziehung zwischen Anforderungen und Spezifikationen und die daran durchgeführten Tests zu visualisieren (siehe Diagramm unten). Qualifikationstests (unten auf der rechten Seite des V) basieren auf Ihrer beabsichtigten Verwendung und der Funktionalität, die erforderlich ist, um diese Verwendung zu erfüllen (unten auf der linken Seite des V dargestellt).
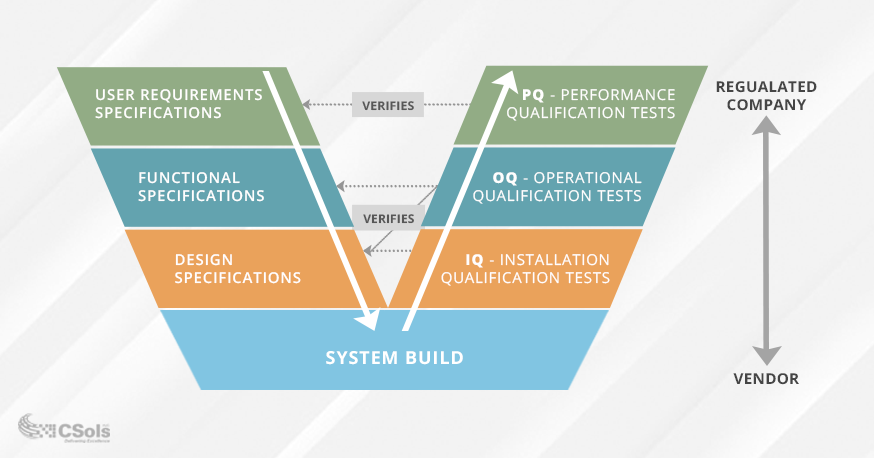
- Die Spezifikation der Benutzeranforderungen dokumentiert, wozu die Benutzer das System benötigen, und PQ-Tests überprüfen diese Anforderungen.
- Die Spezifikation der funktionalen Anforderungen dokumentiert die Systemfunktionalität, die erforderlich ist, um die Spezifikation der Benutzeranforderungen zu erfüllen, und OQ-Tests überprüfen diese Spezifikationen.
- Die Designspezifikationen dokumentieren das Systemdesign (z. B. Module, Einheiten usw.), und IQ-Tests bestätigen, dass die Installation des Systems diese Designanforderungen erfüllt.
IQ / OQ / PQ-Tests sind wohl ein wesentlicher Bestandteil des Validierungsprozesses. Durch den erfolgreichen Abschluss der Tests wird sichergestellt, dass Ihr System wie vorgesehen funktioniert und für die beabsichtigte Verwendung in Ihrer Umgebung geeignet ist. Es empfiehlt sich, Ihre Benutzeranforderungen und funktionalen Spezifikationen vor dem Testen zu genehmigen, um ein Kriechen des Umfangs und mögliche erneute Tests zu vermeiden.
Um mehr über IQ OQ PQ-Tests zu erfahren, schauen Sie sich unser Webinar an.
Die Personen, die Ihre IQ / OQ / PQ-Tests schreiben und ausführen, sollten mit Ihrem Laborinformatiksystem (LIMS, ELN, CDS) und Ihrem Verwendungszweck vertraut sein. Wenn Ihre internen Mitarbeiter nicht über die Bandbreite oder Erfahrung für ordnungsgemäße Tests verfügen, sollten Sie mit qualifizierten CSV-Beratern wie CSols zusammenarbeiten, die über die erforderliche Erfahrung mit Ihren Informatiksystemen verfügen.
ALCOA+ und Datenintegrität
Die Bedeutung von Laborinformatikdaten ist nicht zu unterschätzen. Wenn Sie Daten in einer validierten Umgebung haben, müssen Sie sicherstellen, dass Ihre Daten sicher und zuverlässig bleiben. Das Akronym ALCOA identifiziert die fünf Grundprinzipien der Datenintegrität: Daten müssen zuordenbar, lesbar, zeitgleich, Original und genau sein. In jüngerer Zeit wurden vier zusätzliche Prinzipien hinzugefügt, so dass das Akronym jetzt ALCOA + lautet. Die vier Ergänzungen sind vollständig, konsistent, dauerhaft und verfügbar.

Datenintegrität ist integraler Bestandteil aller Validierungsaktivitäten. Die Einhaltung der Prinzipien von ALCOA + stellt sicher, dass Ihr System Daten erfasst, erstellt, meldet, überträgt und speichert, die sicher, nach Belieben abrufbar und zuverlässig sind.
Die Zukunft der CSV: Computer System Assurance
Obwohl wir immer noch darauf warten, dass die FDA ihre erwarteten Leitlinien zur Computer System Assurance (CSA) veröffentlicht, kommt sie. Im Kern stärkt CSA einen risikobasierten Ansatz, der auf den GAMP 5-Prinzipien des Produkt- und Prozessverständnisses, des Qualitätsrisikomanagements und der Nutzung von Lieferantenaktivitäten aufbaut. Das Risiko wird anhand des Gesamtbildes des gesamten Geschäftsprozesses bewertet. Dies legt mehr Wert auf die Testeffizienz und konzentriert sich auf Tests, die sicherstellen, dass das System für den Zweck geeignet ist.
Herausforderungen bei der Validierung von Computersystemen
Die Validierung von Computersystemen kann Herausforderungen mit sich bringen, darunter das Risiko eines Systemausfalls, restriktive Unternehmensrichtlinien und immer strengere regulatorische Anforderungen. Ein weiteres wichtiges Problem ist, wenn Benutzer die Gleichung zwischen Risiko und Kosten ausgleichen müssen, nachdem Risikokategorien definiert wurden. Ein risikobasierter CSV-Ansatz kann dazu beitragen, einige dieser Herausforderungen zu mindern.
Weitere Schritte, die Sie ergreifen können, um Validierungsprobleme zu vermeiden, sind die folgenden:
- Sicherstellen, dass Ihr Validierungs-Masterplan vollständig ist und den Best Practices und Vorschriften der Branche entspricht
- Definition des zu validierenden Computersystems (d. h. Hardware, Software, Personen und Prozesse)
- Bereitstellung klarer Grenzen für Ihre erwarteten Ergebnisse; d. H., what is acceptable
- Beschreibung und Erfüllung gründlicher Anforderungen und Spezifikationen für die beabsichtigte Verwendung der Software
Die ordnungsgemäße Ausführung einer Computersystemvalidierung ist ein komplizierter Prozess, aber Sie können dies tun, wenn Sie über das richtige Fachwissen verfügen. Wenn Sie nicht sicher sind, ob Ihre internen Mitarbeiter über die erforderliche CSV-Erfahrung verfügen, wenden Sie sich an uns.