Chirurgie de la cataracte actuelle / Revista Médica Clínica Las Condes
Introduction
Dans les données de l’Organisation mondiale de la Santé, si l’on considère les causes de cécité dans le monde, la cataracte (opacification du cristallin) occupe la première place avec 47,9% des cas (1), allant de 5% en Europe et en Amérique du Nord à plus de 50% dans les pays à haut niveau de pauvreté.
En raison du vieillissement progressif de la population mondiale, nous ne nous attendons pas à une diminution de son incidence. Aux États-Unis les résultats du projet de recensement de 1994 indiquent qu’en 2030, une personne sur 5 aura plus de 65 ans (2).
Le type de cataracte le plus courant est lié à l’âge (cataracte sénile), qui commence à apparaître à partir de la sixième décennie (3). Comme il n’existe pas de traitement pharmacologique pour la cataracte, le traitement standard est l’ablation chirurgicale du cristallin opacifié et l’implantation d’un cristallin intraoculaire artificiel (LIO).
La chirurgie de la cataracte au cours des 20 dernières années a généralement été une histoire de succès successifs. Les améliorations constantes de la technique chirurgicale, ainsi que de la technologie des lentilles intraoculaires (IOL), des instruments, des médicaments, ont permis des temps opératoires de plus en plus courts, des interventions de moins en moins traumatisantes, des postopératoires plus courts et mieux tolérés, et des résultats de plus en plus satisfaisants et prévisibles pour nos patients (4).
Ceci est corroboré par la réduction progressive des complications postopératoires (5), à titre d’exemple, l’endophtalmie postopératoire est actuellement tabulée à 0,015% (6).
Cet article montrera les manifestations cliniques de la cataracte, la méthode de traitement actuelle et les soins périopératoires. Les avantages des différents types d’IOL, ainsi que les complications possibles et leur fréquence, seront discutés.
Types de cataracte
Il existe de nombreuses causes et variétés, il existe donc également de nombreuses façons de les classer. Une façon fondamentale de les différencier est de les séparer en congénitales et acquises (séniles, traumatiques, toxiques, radiations, médicaments).
La cataracte congénitale est définie comme l’opacité du cristallin présent à la naissance ou se développant au cours de la première année de vie (7). Ses causes comprennent les infections intra-utérines, les maladies métaboliques et une grande variété de syndromes congénitaux. Les infections intra-utérines qui causent le plus souvent des cataractes sont la rubéole, la rougeole, l’herpès simplex, la varicelle, la grippe, la syphilis et la toxoplasmose. Les causes congénitales comprennent la galactosémie, la trisomie 21, la trisomie 13, la cataracte congénitale familiale et le syndrome de Lowe (8).
Les cataractes acquises sont beaucoup plus fréquentes et en leur sein le type le plus courant est la cataracte sénile, avec ses 3 variétés principales: périphérique, nucléaire et sous-capsulaire postérieure. Différents types d’opacité compromettent la vision de différentes manières (9); par exemple, l’opacité nucléaire diminue l’acuité visuelle et la sous-capsule postérieure rend le patient très sensible à l’éblouissement.
Manifestations cliniques
La manifestation centrale de la cataracte est l’aggravation de la vision, qui est généralement progressive lentement. La déficience ne se limite pas à l’acuité visuelle, elle compromet également d’autres aspects tels que la vision de contraste, la saturation des couleurs et l’éblouissement (figures 1 et 2). Le patient signale des difficultés lors du changement d’environnement avec différents degrés d’éclairage, peut présenter des halos autour des lumières, des problèmes de conduite de nuit (en particulier avec les lumières des véhicules circulant dans la direction opposée) et une lecture limitée avec l’éclairage habituel. L’opacification du noyau cristallin peut se manifester par une augmentation du pouvoir réfractif de celui-ci, ce qui permet au patient pendant un temps variable de lire sans porter de lunettes, jusqu’à ce que finalement la vision de près soit également compromise.

“Pont sur un étang de Nénuphars”, par Claude Monet, avant de développer une cataracte.

Claude Monet, après avoir développé une cataracte. En 1915, il écrit : ” les couleurs n’ont plus la même intensité pour moi… les rouges commencent à paraître nuageux… ma peinture devient de plus en plus sombre”
Étude préopératoire
L’évaluation initiale du patient comprend une anamnèse détaillée, en recherchant spécifiquement des causes de cataracte autres que le vieillissement lui-même, telles que des maladies métaboliques ou dégénératives, l’utilisation de stéroïdes, des antécédents de traumatisme oculaire ou une autre pathologie intraoculaire concomitante.
Des tests généraux (numération formule sanguine, urine, électrocardiogramme au repos, urémie et glycémie) complètent l’évaluation.
Dans l’histoire, il est très important d’enregistrer l’utilisation de médicaments spécifiques tels que l’aspirine, les anticoagulants et dernièrement la Tamsulosine.
L’utilisation d’anticoagulants ou d’aspirine n’est pas une contre-indication à la chirurgie de la cataracte, car elle est réalisée sur des structures avasculaires (cornée et cristallin), et dans la grande majorité des cas elle est utilisée sous anesthésie topique (10), ce qui élimine le risque de ponction de l’anesthésie locale (rétrobulbaire ou péribulbaire).
En 2005, David Chang (11) a décrit le Syndrome peropératoire de l’Iris flasque (IS) secondaire à l’utilisation de la Tamsulosine. Cet antagoniste sélectif a1A utilisé pour le traitement de l’hyperplasie bénigne de la prostate (également utilisé chez les femmes présentant une rétention urinaire) provoque des modifications du comportement de l’iris lors de la chirurgie (ondulation de l’iris stromal, une propension au prolapsus de l’iris vers les incisions opératoires et la constriction progressive de la pupille), le chirurgien doit être conscient du contexte pour modifier le plan chirurgical et prévenir d’éventuelles complications, qui augmentent de manière significative chez ces patients.
L’examen ophtalmologique complet permet d’écarter la présence de toute pathologie oculaire associée qui pourrait contribuer ou provoquer à elle seule la diminution de l’acuité visuelle.
L’ophtalmoscopie binoculaire indirecte (examen du fond de l’œil avec le patient dilaté) est essentielle, la périphérie de la rétine doit être évaluée pour les lésions pouvant prédisposer au décollement de la rétine. Les patients subissant une chirurgie de la cataracte ont un risque plus élevé de cette complication au cours de la première année après la procédure (1/1000 contre 1/10.000 dans la population générale), le risque est égal à la troisième année après la chirurgie. S’il existe des lésions prédisposantes, celles-ci doivent être traitées avant la chirurgie de la cataracte.
La kératométrie (mesure du pouvoir réfractif de la cornée) est réalisée pour identifier la présence d’astigmatisme et permettre une analyse ultérieure des options de traitement, qui est généralement réalisée dans le même acte chirurgical.
L’étude devrait également inclure une biométrie oculaire, car pour le calcul de la LIO, il est essentiel de déterminer la longueur axiale du globe oculaire. Il existe actuellement deux méthodes de mesure; l’échographie oculaire (écobiométrie), actuellement utilisée dans les cataractes plus denses, qui ne permettent pas le passage adéquat de la lumière et la biométrie optique (IOLMaster®, Carl Zeiss Meditec®) qui mesure la longueur avec un faisceau infrarouge de 780 nm présente cependant l’inconvénient de ne pas atteindre une bonne pénétration dans les cristaux de cataracte très denses.
Le plan chirurgical
Doit être analysé avec le patient en fonction de ses besoins et de ses attentes.
La technique la plus fréquemment utilisée est la phacoémulsification (12), dans laquelle le cristallin est émulsionné et aspiré à travers une pointe ou une aiguille qui vibre à haute fréquence (ultrasons).
Cette pointe ou aiguille est reliée à la console du phacoémulfateur, où les puissances des trois fonctions principales sont ajustées: l’irrigation qui permet de maintenir les espaces à l’intérieur de l’œil, l’émission d’ultrasons (puissance) qui provoque la perturbation et l’émulsification du cristallin de la cataracte et le flux d’aspiration qui élimine le matériau émulsionné. Ces fonctions sont contrôlées par le chirurgien à l’aide d’une pédale.
De nombreux progrès ont été réalisés dans la technique ces dernières années, s’améliorant considérablement en termes de sécurité et d’efficacité (12, 13), ce progrès est lié et n’est possible que par l’évolution technologique constante.
Cette évolution a permis d’utiliser de moins en moins d’énergie, mais de manière beaucoup plus efficace, ce qui réduit le temps de fonctionnement, la quantité d’énergie libérée et la production de chaleur. La diminution du temps opératoire réduit le traumatisme sur les structures intraoculaires, en particulier l’endothélium (couche cellulaire qui recouvre la face interne de la cornée, responsable de sa déshydratation et de sa transparence conséquente). Cette réduction est toujours bénéfique, par exemple aux États-Unis. La première cause de transplantation cornéenne est l’insuffisance endothéliale secondaire à une chirurgie de la cataracte (kératopathie buleuse pseudophachique). La diminution des temps opératoires est également liée à la réduction de l’incidence des endophtalmies post-chirurgicales, ces infections dévastatrices (5, 6) sont produites par la flore habituelle qui pénètre dans l’œil pendant la chirurgie ou dans la période périopératoire immédiate. D’autre part, la diminution de l’énergie libérée et de la production de chaleur réduit les changements thermiques dans les plaies chirurgicales, les rendant plus stables et hermétiques, rendant la colonisation bactérienne plus difficile (14).
L’analyse des options est réalisée en fonction des besoins du patient, qu’elle nécessite de privilégier la vision de près, la vision de loin ou préfère une solution pour les deux. Il est essentiel d’identifier leur niveau de demande, d’activité, le désir d’indépendance des lunettes et la présence d’astigmatisme.
La chirurgie actuelle vise à apporter une solution globale au problème de réfraction, c’est pourquoi il existe des solutions associées à la LIO (multifocalité, correction de l’astigmatisme) et aux procédures adjuvantes qui sont effectuées dans le même acte chirurgical ou plus tard.Les lentilles intraoculaires
offrent deux alternatives de base: les lentilles monofocales et les lentilles multifocales. Dans les monofocales, il y a avec et sans correction de l’astigmatisme (lentilles toriques). L’astigmatisme correspond à une affection très courante, dans laquelle la cornée est plus incurvée dans l’un de ses méridiens, ce qui provoque une distorsion plus ou moins grande de la vision. Les images sont perçues avec de l’ombre, diffuses ou doubles.
Les lentilles monofocales offrent une vision de très bonne qualité, avec une très bonne sensibilité au contraste et peu de problèmes nocturnes (halos), mais elles ont la limitation qu’elles ne voient qu’à une distance focale, soit de loin (choix le plus fréquent dans monofocal) ou de près; pour le reste des distances, il est nécessaire d’utiliser des lunettes. Chez les patients qui choisissent le monofocal et présentent un astigmatisme faible (15), la plaie chirurgicale est réalisée dans le méridien de plus grande courbure cornéenne afin d’aplatir cet axe, la biomécanique de la cornée fait plier le méridien plus plat par couplage et l’astigmatisme disparaît. Ceci est utile dans les petits astigmatismes de 0,50 à 0,75 dioptries.
Chez les patients présentant un astigmatisme majeur, des incisions limbaires relaxantes sont pratiquées (Figure 3), constituées de coupes circonférentielles précises, réalisées à la périphérie de la cornée, centrées sur le méridien le plus incurvé. Les degrés d’arc des incisions varient en fonction de l’ampleur de l’astigmatisme et de l’âge du patient. La profondeur est fixée à 600 microns.
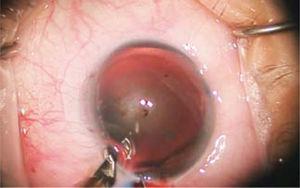
Une coupe circonférentielle d’épaisseur partielle appelée Incision limbaire relaxante (ILR) est observée pour la prise en charge de l’astigmatisme
Si l’astigmatisme est supérieur à 1,50-1,75 dioptries, des lentilles toriques monofocales (avec correction de l’astigmatisme) sont utilisées. Ceux-ci permettent de corriger jusqu’à 4 dioptries d’astigmatisme. Lorsque l’astigmatisme est plus important peut être sous-corregir, utilisez le LASIK (chirurgie réfractive au laser) ou une combinaison de lentille intraoculaire torique et de LASIK (Bioptics).
Les lentilles multifocales ont le grand avantage de libérer les lunettes dans la plupart des situations. Ils délivrent une très bonne vision de près et une bonne vision de loin, considérant également qu’ils permettent leur multifocalité, une bonne à très bonne vision intermédiaire.
La limitation de son utilisation est donnée par les conditions du patient. En cas de pathologie (problèmes rétiniens, glaucome avec atteinte du champ visuel), son utilisation n’est pas recommandée. De la même manière, les patients très exigeants ne sont pas les meilleurs candidats.
La conception de l’objectif (figure 4) présente encore certaines limites; la sensibilité au contraste est diminuée, ce qui limite en pratique la vision dans des situations de faible éclairage. Ils ont une vision des halos et des reflets lors de la conduite de nuit. La netteté n’est pas complète, elle est très bonne, mais les patients très exigeants remarquent cette différence.

On observe les cercles concentriques qui déterminent la multifocalité. Cette conception détermine également la présence de halos nocturnes.
La grande majorité des patients fait très bien face à ces limitations en étant conscients qu’il s’agit d’un produit de conception, qui est le “prix à payer” pour la libération des lunettes. Ces malaises diminuent considérablement avec le temps.
Sont combinés avec les mêmes techniques décrites ci-dessus en cas d’astigmatisme. Fin octobre, des lentilles intraoculaires multifocales toriques seront disponibles au Chili pour corriger l’astigmatisme de près, de loin, intermédiaire et jusqu’à 2,5 dioptries.
Chirurgie
La chirurgie ne nécessite pas de préparation spéciale, à l’exception de la dilatation pharmacologique de la pupille, ce processus prend environ 30 minutes. Pendant cette période, des gouttes d’antibiotiques prophylactiques (dont l’utilisation n’a pas montré de prévention statistiquement significative de l’endophtalmie post-chirurgicale) et des anti-inflammatoires non stéroïdiens (dont l’utilisation a montré la prévention du myosis peropératoire) sont instillées.
Avant la mise en place des rideaux chirurgicaux, 1 goutte d’iodate de polyvidone à 5% doit être instillée dans chaque fond du sac conjonctival (16, 17), une mesure qui s’est avérée réduire statistiquement de manière significative le risque d’endophtalmie post-chirurgicale chronique (principalement due à P. Acné).
La chirurgie se fait sous anesthésie topique (18), en instillant des gouttes de pro-paracaïne ou de tétracaïne, la sédation doit être superficielle car elle permet la coopération du patient pendant la procédure. L’anesthésie topique, en plus de l’approche chirurgicale cornéenne, rend la chirurgie possible chez les patients sous traitement anticoagulant ou antiplaquettaire.
Dans les cas nécessitant une correction de l’astigmatisme, la cornée du patient doit être marquée en position assise, en identifiant l’axe de 0 à 180 °.
La chirurgie prend environ 30 à 45 minutes.
Après avoir isolé les cils, qui correspondent à la principale source de contamination bactérienne, un spéculum de paupière (blépharostat) est utilisé pour garder l’œil ouvert pendant la chirurgie, permettant au patient de se désengager des clignotements.
Au microscope, on réalise une plaie principale comprise entre 1,8 et 2,75 millimètres, à travers laquelle l’aiguille ou la pointe du phacoémulsifiant et une ou deux paracentèses (plaies secondaires pour instruments de support) sont insérées.
La chambre antérieure est remplie de matériau viscoélastique, ce qui permet le maintien des espaces et protège les structures intraoculaires, principalement l’endothélium cornéen. Dans ces conditions de stabilité et de sécurité, une ouverture circulaire continue (capsulorhexis) est construite dans la capsule antérieure de la lentille, d’environ 4,5 à 5 millimètres de diamètre (Figure 5). Ceci est fait avec une pince à épiler ou une aiguille modifiée (cystotome).
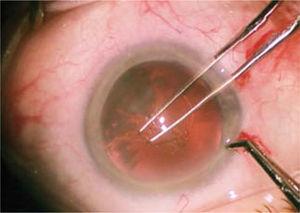
Réalisation de capsules circulaires continusexl avec une pince, d’un diamètre de 4,5 à 5 millimètres.
À l’aide de sérum, les fibres cristallines sont séparées du sac capsulaire qui les entoure, dans un processus appelé hydrodissection (ce sac correspond à la membrane basale de l’épithélium cristallinien, et a une épaisseur comprise entre 9 et 20 microns).
A ensuite effectué une phacoémulsification du cristallin cataratoso, en introduisant la pointe ou l’aiguille facoemulsificador plaie primaire et des instruments de support pour la paracentèse ou les plaies secondaires, qui aident à fragmenter la cataracte et à offrir ces fragments à la pointe de l’aiguille de manière séquentielle et systématique.
Le sac est nettoyé des résidus de fibres, qui sont aspirés manuellement ou automatiquement. Le sac viscoélastique est ensuite rempli pour se dilater et la lentille intraoculaire est injectée (Figure 6) à l’intérieur.
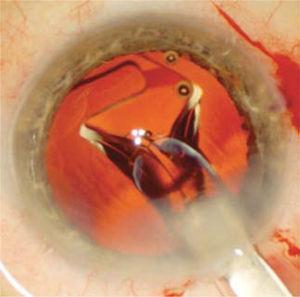
On observe que la LIO commence à se dilater dans le sac capsulaire lorsqu’elle est injectée à travers la plaie opératoire. Ce déploiement est doux et contrôlé pour éviter d’endommager le sac capsulaire.
S’il s’agit d’une lentille torique, elle tourne jusqu’à ce que les marques de lentille soient alignées avec les axes précédemment marqués sur la cornée.
Un lavage soigneux du matériau restant est essentiel, avec élimination de toute la viscoélastique présente; il est particulièrement important de nettoyer le sac derrière la lentille intraoculaire pour éviter les complications postopératoires.
Les plaies sont hydratées en vérifiant leur étanchéité. Si les plaies ne sont pas étanches à l’air, elles doivent être suturées pour éviter les infiltrations. Cette suture est réalisée avec du monofilament de nylon 10-0 et est retirée 7 jours après l’opération.
L’œil opéré doit être protégé avec un certain type de bouclier, celui de choix est en plastique transparent, qui doit être utilisé pendant 3 nuits, pour éviter les traumatismes accidentels pendant le sommeil.
Évolution postopératoire
La récupération après chirurgie est assez rapide. De nombreux patients peuvent reprendre leurs activités habituelles à partir du lendemain.
La vision s’améliore progressivement à mesure que la pupille revient à sa taille normale, un processus qui prend généralement moins de 24 heures. Pendant les premières heures, il est courant que les patients décrivent la présence de rougeâtre ou la présence de halos sous une forme transitoire. Ceci est donné par l’effet de la lumière du microscope sur la rétine.
Le traitement postopératoire consiste en l’instillation de gouttes ophtalmiques antibiotiques (quinolones de 4ème génération actuellement préférées (19), de corticostéroïdes (prednisolone 1%) et d’anti-inflammatoires non stéroïdiens. Ces derniers (20) sont utilisés dans la prévention de l’œdème maculaire kystique, une complication subclinique fréquente de la chirurgie intraoculaire, qui, lorsqu’elle est clinique, entraîne une diminution de la vision aiguë et chronique. Les médicaments oraux ne sont pas nécessaires car les concentrations intraoculaires atteintes par les gouttes oculaires sont beaucoup plus élevées.
Complications
Les complications sont généralement peu fréquentes (21) (moins de 1% des cas).
Au sein de la peropératoire, ceux associés à une anesthésie locale (injection péribulbaire, ou rétrobulbaire), tels qu’une hémorragie, une rétrobulbaire, une perforation du globe oculaire et même une paralysie respiratoire (par injection dans la gaine du nerf optique et à travers celle-ci jusqu’à l’espace sous-arachnoïdien) sont extrêmement rares en eux-mêmes (22) (0,066%), maintenant avec l’utilisation de presque la règle de l’anesthésie topique (anesthésiques en gouttes oculaires) sont des événements extraordinaires. Le risque de saignement n’augmente pas de manière significative avec l’utilisation de l’anesthésie topique, même chez les patients anticoagulés (22). D’autres complications comprennent une déchirure capsulaire, une perte du vitré, un épanchement choroïdien et une hémorragie expulsive.
Dans la période postopératoire, les plus fréquentes sont généralement transitoires (œdème cornéen, augmentation de la pression intraoculaire).
Les complications graves telles qu’une endophtalmie, des saignements et une perte de vision sont rares en fréquence (21) (0.015%, 0.02%, et moins de 0,01%, respectivement).
Le risque de décollement de la rétine est 10 fois plus élevé que dans la population générale au cours de la première année, étant égal à la troisième année postopératoire (23). Il est conseillé aux patients de consulter pour une vision lumineuse (comme la foudre), une vision ponctuelle ou une combinaison des deux. Tous ces symptômes se traduisent par une traction rétinienne et nécessitent un examen du fond d’œil dilaté pour détecter une déchirure ou un décollement de la rétine. Plus le diagnostic est précoce, meilleure est la réponse au traitement, que ce soit au laser ou à la chirurgie.
La complication postopératoire la plus fréquente est la dite “cataracte secondaire”, qui en réalité ne correspond pas à une nouvelle cataracte (car le cristallin est complètement retiré lors de la chirurgie), mais à l’opacification du sac capsulaire par prolifération et métaplasie, cellules épithéliales fibreuses isolées, a atteint jusqu’à 50% à 5 ans (24), avec les modèles les plus anciens de Ceux-ci, mais n’atteint actuellement pas 3% à 5 ans (25) avec les nouveaux modèles. Sa prise en charge est très simple et consiste à effectuer une capsulotomie au laser, une procédure ambulatoire et pratiquement exempte de morbidité.
Une question très courante pour les patients est de savoir combien de temps dure la LIO ou si elle doit être modifiée de temps en temps. Depuis la première LIO introduite en 1949 (26), aucune publication ne suggère une usure du matériau conduisant à son remplacement ou à son remplacement.
Résultats
Le principal critère de réussite en chirurgie de la cataracte, dans une chirurgie simple, est l’acuité visuelle (combien notre patient peut voir).
Actuellement, dans les yeux sans pathologie associée, 95% des patients atteignent une acuité visuelle de 20/30 ou mieux (21) (correspondant à 90% ou plus).
En revanche, nous sommes obligés de mesurer la qualité de la vision, qui correspond à la capacité de bien voir dans le contexte des exigences visuelles individuelles (comme notre patient parvient à le voir). Plusieurs mesures objectives et subjectives sont utilisées pour le déterminer (21).
A titre d’exemple, dans le cas des IOL multifocales (27), entre 85% et 96% des patients déclarent ne pas porter de lunettes dans n’importe quelle situation. Plus de 90 % jugent leur vison de près et de loin très bon ou excellent (28).
Cependant, les lentilles multifocales nécessitent une période d’adaptation pour tirer pleinement parti de leurs avantages, cette période de formation varie d’une personne à l’autre et varie de quelques jours à 2-3 mois.
Conclusion
La technologie continue son évolution, et très bientôt nous disposerons de lentilles intraoculaires réglables, qui peuvent être modifiées en période postopératoire, de manière non invasive, pour corriger tout défaut résiduel. La chirurgie sera de plus en plus automatisée pour diminuer le risque d’erreur. Des plaies plus petites et mieux construites réduiront le risque d’infection. La chirurgie au laser est en plein développement, ce qui conduira à une plus grande standardisation et à une sécurité conséquente.
Comme nous l’avons examiné dans ces pages, la chirurgie de la cataracte actuelle offre des niveaux élevés de prévisibilité (plus de 95% d’acuité visuelle supérieure ou égale à 20/30) et de sécurité (perte d’acuité visuelle dans moins de 1% des cas) (21, 27, 28).
Cela nous permet d’offrir à nos patients un résultat visuel et une amélioration très significative de la qualité de vie, avec des niveaux de satisfaction subjective et d’amélioration objective supérieurs à 90%, associés à des complications graves à des niveaux inférieurs à 0,02%.
En raison des caractéristiques de notre population, cette chirurgie sera de plus en plus fréquente, mais les améliorations constantes et soutenues de son traitement nous font envisager cet avenir avec un optimisme fondé.