細胞生物学におけるタンパク質-フラグメント相補アッセイの応用
はじめに
生化学的経路は、実際にはタンパク質複合体を動的に組み立て、分解するシステムであり、したがって、現代の生物学的研究の多くは、タンパク質が生化学プロセスに関与する他のタンパク質とどのように、いつ、どこで相互作用するかに関係している。 タンパク質-タンパク質相互作用、特に大規模な研究のための簡単なアプローチの需要は、既知の遺伝子産物と未知の関連付けが遺伝子の機能を確立す この課題を念頭に置いて、私たちの研究室では、タンパク質断片相補アッセイ(PCAs)を開発しました。 この戦略では、目的の二つのタンパク質(タンパク質AとB)は、レポータータンパク質(酵素、蛍光タンパク質など)の相補的な断片に融合されています。). タンパク質AとBが相互作用すると、レポーター断片が一緒になり、レポーターの本来の構造に折り畳まれ、その活性を再構成する(図1)。 PCAレポータータンパク質は、蛍光、発光、および比色信号だけでなく、単純な生存選択アッセイ(1-14)を含む検出可能な活性の様々な生産するものとして選択されて 我々は、PCA戦略は、次の機能を持っていることを実証している:(i)これは、任意の細胞型におけるin vivoおよびin vitroでのタンパク質-タンパク質相互作用の検出を可; (ii)適切な細胞内コンパートメントまたはオルガネラにおけるタンパク質-タンパク質相互作用の検出を可能にします。(iii)それは、特に発達、栄養、環境、またはホルモン誘発シグナルに応答して誘導される相互作用の検出を可能にします。(iv)それは、細胞内のタンパク質アセンブリの速度論的および平衡側面のモニタリングを可能にします。(v)それは、任意の細胞型における新規なタンパク質-タンパク質相互作用のスクリーニングを可能にします(2,3,6,9)(15-19)。
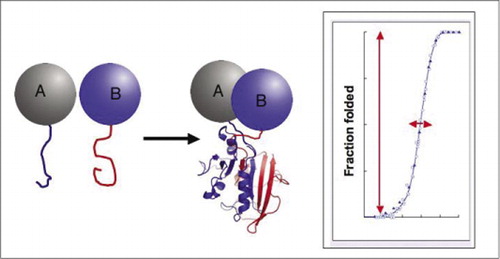
二つのタンパク質が相互作用すると、レポーター断片が一緒になり、レポータータンパク質の天然構造に折り畳まれ、その活性が再構成される(左)。 これらのタンパク質断片相補性アッセイ(PCAs)は、動的タンパク質複合体のレポーターとしてそれらを特に有用にする物理的特性を有する。 右側にはタンパク質の折り畳み曲線があり、x軸はいくつかの可変パラメータ(例えば、 の濃度、別の断片に対する1つの断片の濃度)。 このプロセスの高い協同性(非常に狭い範囲上の折られた種の一部分の非常に鋭い増加)は試金に複雑の検出を事実上のすべてまたはなし現象にさせる巨大なダイナミックレンジがあることを意味する。 これは、ダイナミックレンジが非常に低く、多くのパラメータを慎重に最適化する必要がある蛍光共鳴エネルギー移動(FRET)などの方法とは対照的です。 対照的に、PCAによるタンパク質複合体形成の測定は、無傷のレポーター酵素の活性を測定するよりも困難ではない。
原理
我々は、レポーターとして酵素ジヒドロ葉酸レダクターゼ(DHFR)から始まるPCAの原理を実証しました(1)。 その断片からの酵素の折り畳み(活性の再構成によって検出されるように)が相互作用するタンパク質の結合に絶対的に依存していた場合、記述された系は、実際には相互作用の検出器であることは明らかであった。 我々と他の人は、以来、この原理は、GaussiaとRenillaルシフェラーゼ、TEM β-ラクタマーゼだけでなく、緑色蛍光タンパク質(GFP)とその変異体(1-14)を含む酵素の数に一般化するこ PCA断片の重要な特徴は、それらが融合しているタンパク質の相互作用によって近接することなく、自発的に折り畳まれないように設計されているこ 自発的な折り畳みが発生した場合、PCAは単に機能しません。 自発的な折りたたみは、偽陽性信号、絶望的に(重要なアプリケーションであることが予想される)in vivoでのライブラリ画面の解釈を混乱させる状況につ PCAとは対照的に、PCAに似ているが、概念的かつ実質的に異なるβ-ガラクトシダーゼおよびスプリットインに基づくアッセイ系がある(21,22)。 いずれの場合も、よく知られている天然に存在し、自発的に関連する酵素のサブユニットは、相互作用するタンパク質に融合されている。 ここでの中心的な問題は、サブユニットは、たとえ弱く関連していても、常にある程度そうすることができ、自発的な集合の一定の背景があることを
制限
PCA戦略は、単一の酵素レポーターに限定されないという意味で一般的であり、いくつかの異なる形で考案されており、それぞれが特定の質問に対 例えば、DHFRに基づくもののような単純な生存選択Pcaは、ライブラリー選択に最も有用であり、発光または蛍光読み出しPcaはタンパク質複合体の空間的およ 融合タンパク質は、特定の生化学的経路を研究するための関連するモデルである細胞で発現することができるので、正しい翻訳後修飾を含むネイティブの生物学的状態にある可能性が高い(明らかにPCA断片自体がタンパク質の標的化または修飾を妨げてはならず、これはテストされなければならない)。
最も単純であり、したがって最も一般的なPcaの中には、蛍光タンパク質(GFPや変異体など)に基づくものがあり、シグナルは内在的な蛍光体(7-9)(14,15,17,23)によ しかし、蛍光タンパク質は、シグナルが背景細胞の蛍光を上回っていることを保証するために高レベルで発現されなければならず、蛍光タンパク質PCAsは不可逆的であることが実証されている(まれな複合体を捕捉して可視化する)が、相互作用するタンパク質のターンオーバーや局在の誤解につながる可能性もある(8,23,24)。 一方、DHFRとβ-ラクタマーゼをレポーターとするPcaは、間接的な証拠に基づいて、相互作用の中断後に可逆的であることが実証されており、Gaussiaルシフェラーゼに基づくPCAは直接可逆的であることが示されている(2,3,6)。 したがって、PCAの可逆性は、生きている細胞におけるタンパク質複合体の集合および分解の速度論的および平衡的側面の検出を可能にする(図2)。
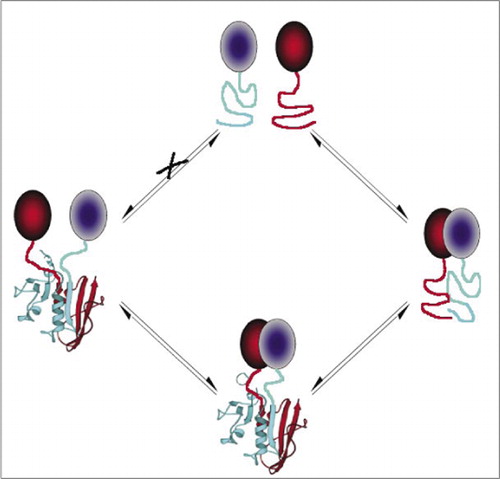
これは、偽のシグナルにつながる可能性のある断片(経路X)の自発的な会合を防止する。 同様に、タンパク質複合体が破壊されたときに断片の自発的な展開が起こるべき断片が選択される(左側)。
PCA研究のための標準対照
PCA戦略では、目的のタンパク質が複合体を形成した後にレポータータンパク質の断片を組み立てて折り畳む必要があります。 レポーターのアセンブリおよび正しい折りたたみはレポーター蛋白質に本質的な構造幾何学と相互に作用する蛋白質によって形作られる複合体の両方の回復に依存している。 これは、蛍光共鳴エネルギー移動(FRET)または生物発光共鳴エネルギー移動(BRET)または酵母ツーハイブリッドアッセイと比較してPCAアッセイの主要な違いの一つであり、この機能は、私たちはエリスロポエチン受容体(19)の構造ベースの研究を行うことができました。 我々は、典型的には、からなる10アミノ酸柔軟なポリペプチドリンカー(Gly.グリーグリーグリー目的のタンパク質とPCAレポーター断片との間の(両方の融合のための)ser)2。 このリンカーは、可能な限り柔軟であるために選択された、と我々は経験的にこの長さのリンカーは関係なく、断片が融合されている相互作用するタンパク質の大きさの、お互いを見つけて折り畳むために断片を可能にするのに十分に長いことが観察されている(16)。
非特異的な応答が発生しないようにするには、一連の制御を実行する必要があります。 これらの対照は、最初のものが最も重要であるが、以下を含むことができる:(i)非相互作用タンパク質。 非相互作用タンパク質がPCAパートナーとして使用される場合、PCA応答は観察されるべきではない; また、非相互作用タンパク質のみの過剰発現は、既知の相互作用のために競合すべきではありません。 (ii)パートナー蛋白質インターフェイス突然変異。 相互作用を妨害することが知られているパートナーの点突然変異または欠失突然変異はまた、PCA応答を妨げるべきである。 (iii)競争。 PCA応答は、相補的PCA断片に融合されていない相互作用するタンパク質の一方または他方の同時過剰発現によって減少されるべきである。 (iv)フラグメントスワッピング。 タンパク質がそれぞれのレポーター断片と交換されていても、二つのタンパク質間の観察された相互作用が起こるはずである。
タンパク質設計におけるPCAの応用:最適に相互作用するタンパク質のライブラリVs.ライブラリスクリーニング
PCAの最初の応用の中で、タンパク質設計の問題にあった。 DHFR PCAアッセイは、我々は実質的に106をカバーすることができる1010潜在的な相互作用ペアと相補的に設計されたロイシンジッパー形成配列の二つのライブラ 我々は、PCA画面は、最適な結合特異性だけでなく、溶解性と相互作用ジッパー(18,25)の発現の両方のために選択されたことを実証しました。 このアプローチの最も重要な特徴は、2つのライブラリを互いに同時にスクリーニングすることが可能であったことであり、同等の酵母2ハイブリッドスクリーンでは容易に達成されないプロセスであった。 このアプローチの単純さと設計戦略について得られた情報の特定の性質は、タンパク質設計と指向進化実験におけるDHFR PCAの広範な有用性を示唆して また、PCAは、全体の選択、最適化、および文字列テストは、このアプローチを容易に実行すること、in vivoで行われているので、ファージディスプレイ戦略を補完
哺乳動物細胞におけるcDNAライブラリースクリーニングへのPCAの適用
新規遺伝子産物の機能を定義する最初のステップは、他の遺伝子産物との相互作用を決定することである。 しかし、純粋にタンパク質相互作用に基づくスクリーニングアプローチ(酵母ツーハイブリッドなど)は、二つのタンパク質が相互作用することを示すだけで したがって、我々はPCAは、相互作用(9)の生物学的関連性の初期検証を提供する特定の機能アッセイと単純な細胞ベースのタンパク質相互作用スクリーンを組 最初のステップは、無傷の生きている細胞におけるPCAレポーターの再構成を監視することにより、餌とcDNAコードされた獲物タンパク質のライブラリとの間の物理的相互作用のためのスクリーニングで構成されています。 この最初のステップの重要な特徴は、相互作用が直接、餌タンパク質が正常に機能する細胞内の全長タンパク質間で検出できることであり、必要な細胞内ターゲティング、翻訳後の修飾、および他のタンパク質との相互作用が起こることを保証することである。 明らかに、実験的妥当性のために、PCA断片は、タンパク質の標的化または改変に干渉しないことを実証されなければならない。 第二段階では、タンパク質の相互作用は、次のように機能的に検証することができます: 第一に、PCAによって検出されるタンパク質相互作用は、タンパク質が関与する特定の生化学的経路を調節することが知られているホルモンまたは特異的阻害剤のような薬剤によって摂動されなければならない。 我々は、DHFR PCAのためにこれを実証し、生きている哺乳動物細胞(におけるシグナル伝達経路をマッピングするために、このプロパティを使用している16)。 第二に、再びPCAによって検出されたタンパク質相互作用の細胞内局在は、経路を調節する薬剤によって変化する可能性がある。 従って、PCAベースのスクリーニングの作戦は直接機能試金と簡単なスクリーニングのステップを結合する。 我々と他の人は、セリン/スレオニンプロテインキナーゼ、PKB/Akt(9,15,26,27)の新規基質またはレギュレータの同定にこの戦略を適用しています。
PCAを分子定規として使用する:受容体研究
PCA戦略の特別な特徴は、レポーター酵素の三次元構造を知っていれば、酵素が正しく折り畳まれ、測定可能な活性を有することを保証するために、断片がどれだけ近いかを正確に予測することができるということである。 この事実は、DHFR PCAを用いて二量体エリスロポエチン受容体(EpoR)の活性化のための構造アロステリックモデルをテストするために働くために置かれ、アプロー EpoRの場合、受容体二量体膜貫通ドメインは、非ligated EpoRの結晶構造で観察されるように、73Åで分離されることが示された。 この不活性状態が生きている細胞の膜上に存在する場合、膜貫通ドメインのC末端に融合したDHFR断片は、リガンドが断片がDHFRの正確な三次元構造が形成されることを保証するのに十分に接近することを可能にする立体配座変化を誘導した場合にのみ折り畳まれると推論された(19,28)。 これは、断片のn末端が8Å離れていることを必要とするであろう。 膜貫通ドメインとDHFR断片の間に柔軟なリンカーペプチドの挿入は、私たちは細胞外ドメイン二量体の挿入点間の距離をプローブし、73Åに及ぶのに十分な長さのリンカーがDHFRがその断片から折り畳むために必要であったことを確認することができました。
生化学ネットワークのマッピング
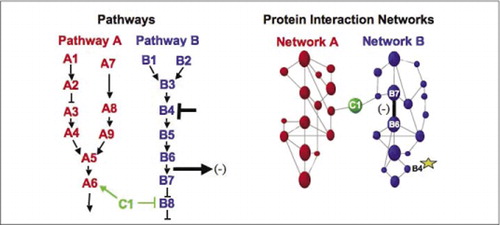
代謝、シグナリングカスケード、および細胞周期のための細胞生化学機械は、動的に高分子複合体を組み立てて分解する例である。 これらは、一連の摂動(ホルモン、代謝産物、酵素阻害剤など)に対するそれらの同様の応答に従って相互作用するタンパク質をグループ化することによ). タンパク質-タンパク質相互作用は、既知の生化学的プロセスに関与することが知られているタンパク質に未知の機能のタンパク質をリンクするた 我々は、薬理学的プロファイリング(タンパク質-タンパク質相互作用に対する経路特異的薬物およびタンパク質ホルモンの影響を監視する)とタンパク質-(9)(15-17)(26). これらの結果の分析は、生化学的ネットワークが時間と空間において、そして特定の刺激に応答してどのように進化するかの表現を可能にする。 原理の証明として、我々は受容体チロシンキナーゼ(RTKs)によって媒介されるシグナル伝達経路のマッピングにこの戦略の適用を報告した(16)。 私たちが観察した相互作用の薬理学的プロファイルと細胞の位置は、各遺伝子産物を経路内の関連点に配置することを可能にしました(図3)。 解析の結果から,既存のモデルと一致したが,いくつかの新しい相互作用を含むRTKネットワークの組織のマップが出現した。 研究された基礎となる経路のすべてのコンポーネントを含む生きた細胞におけるタンパク質相互作用のネットワークを監視する能力は、このネットワー 提示された結果は、PCA戦略は、一般的な遺伝子機能の検証と経路マッピング戦略のために必要な機能を持っていることを示しています。 Pcaの大規模なセットの最近のアプリケーションは、特定のシグナル伝達経路上の薬物の作用をリンクし、薬物の予期せぬ活動を検出するための一般的なアプローチの開発を可能にした(17)。
おわりに
PCAの開発と応用はまだ進行中です。 例えば、ここに記載されている限られた、有益ではあるが、アプリケーションのセットに加えて、戦略は、全体のゲノムの大規模なスクリーニングに適用されています。 タンパク質、タンパク質と核酸、およびタンパク質と小有機分子との間の最適な相互作用のための配列の選択を制御する因子の研究を含む、タンパク質設計とタンパク質折り畳みのより洗練された問題が探求されている。 PCAは非常に一般的で柔軟な実験的アプローチであるため、近い将来、この基本的なツールの分子および細胞生物学への新規な応用が増えることを期待す
謝辞
Stephen Michnickは統合ゲノミクスのカナダ研究委員長を務めています。 私たちの研究室から引用された研究は、カナダの健康研究機関によって資金提供されました。
- 1. Pelletier,J.N.,F.X.Campbell-Valois,およびS.W.Michnick. 1998. 合理的に設計された断片からの活性ジヒドロ葉酸レダクターゼのオリゴマー化ドメイン指向再組み立て。 プロク… ナトル アカド サイ… USA9 5:1 2 1 4 1−1 2 1 4 6.Crossref,Medline,CAS,Google Scholar
- 2. レミー、I.とS.W.Michnick。 1999. クローン選択とタンパク質-フラグメント相補アッセイとタンパク質相互作用のin vivo定量化。 プロク… ナトル アカド サイ… USA9 6:5 3 9 4−5 3 9 9.Crossref,Medline,CAS,Google Scholar
- 3. Galarneau、A.、M.Primeau、L.E.Trudeau、およびS.W.Michnick。 2002. Β-ラクタマーゼ蛋白質断片相補性アッセイは、タンパク質タンパク質相互作用のin vivoおよびin vitroセンサーとして。 ナット バイオテクノール 20:619–622.Crossref,Medline,CAS,Google Scholar
- 4. Wehrman,T.,B.Kleaveland,J.H.Her,R.F.Balint,H.M.Blau. 2002. Β-ラクタマーゼ酵素断片の相補性を介して哺乳動物細胞におけるタンパク質-タンパク質相互作用を監視した。 プロク… ナトル アカド サイ… 米国99:3469-3474。Crossref,Medline,CAS,Google Scholar
- 5. ることができます。 2002. 哺乳類細胞における動的リン酸化依存性タンパク質-タンパク質相互作用のタイムラプスイメージング。 プロク… ナトル アカド サイ… 米国99:15142-15147。Crossref,Medline,CAS,Google Scholar
- 6. レミー、I.とS.W.Michnick。 2006. Gaussiaルシフェラーゼに基づく高感度なタンパク質-タンパク質相互作用アッセイ。 ナット 方法3:977-979.Crossref,Medline,CAS,Google Scholar
- 7. Ghosh,I.,A.D.Hamilton,およびL.Regan. 2000. アンチパラレルロイシンジッパー指向タンパク質再組立て:緑色蛍光タンパク質への応用。 J.Am. ケム Soc. 122:5658–5659.Crossref,CAS,Google Scholar
- 8. Hu,C.D.,Y.Chinenov,およびT.K.Kerppola. 2002. 二分子蛍光相補性を用いた生きた細胞におけるbZIPおよびRelファミリータンパク質間の相互作用の可視化。 モル セル9:789-798。Crossref,Medline,CAS,Google Scholar
- 9. レミー、I.とS.W.Michnick。 2004. シグナル伝達経路の新規成分を同定するための蛍光タンパク質相補性アッセイに基づくcDNAライブラリー機能スクリーニング戦略。 方法32:381-388。Crossref,Medline,CAS,Google Scholar
- 10. レミー,I.,F.X.キャンベル-ヴァロワ,G.Ghaddar,S.Aquin,S.W.Michnick. 2005. タンパク質相互作用の検出とタンパク質断片相補アッセイによるライブラリスクリーニング、p.637-672。 In Protein-Protein Interactions:A Molecular Cloning Manual,2nd ed. CSH Laboratory Press,Cold Spring Harbor,NY.Google Scholar
- 11. Paulmurugan,R.and S.S.Gambhir. 2003. スプリット合成レニラルシフェラーゼプロテインフラグメント支援相補性を用いたタンパク質-タンパク質相互作用の監視。 アナル… ケム 75:1584–1589.Crossref,Medline,CAS,Google Scholar
- 12. Paulmurugan,R.,Y.Umezawa,S.S.Gambhir. 2002. レポーター蛋白質の補足および再構成の作戦を使用して生きている主題の蛋白質-蛋白質の相互作用の非侵襲的なイメージ投射。 プロク… ナトル アカド サイ… 米国99:15608-15613。Crossref,Medline,CAS,Google Scholar
- 13. Luker、K.E.、M.C.Smith、G.D.Luker、S.T.Gammon、H.Piwnica-Worms、およびD.Piwnica-Worms。 2004. 調節されたタンパク質-タンパク質相互作用の速度論は、細胞および生きている動物におけるホタルルシフェラーゼ相補イメージングと明らかにした。 プロク… ナトル アカド サイ… 米国101:12288-12293。Crossref,Medline,CAS,Google Scholar
- 14. Jach,G.,M.Pesch,K.Richter,S.Frings,j.F.Uhrig. 2006. 改良されたmrfp1は、二分子蛍光相補性に赤を追加します。 ナット 方法3:597-600.Crossref,Medline,CAS,Google Scholar
- 15. レミー、I.、A.モンマルケット、S.W.ミチニック。 2004. PKB/AktはSmad3との直接の相互作用を介してTGF-βシグナル伝達を調節する。 ナット セルバイオール 6:358–365.Crossref,Medline,CAS,Google Scholar
- 16. レミー、I.とS.W.Michnick。 2001. 生細胞における生化学的ネットワークの可視化。 プロク… ナトル アカド サイ… 米国98:7678-7683。Crossref,Medline,CAS,Google Scholar
- 17. Macdonald,M.L.,J.Lamerdin,S.Owens,B.H.Keon,G.K.Bilter,Z.Shang,Z.Huang,H.Yu,et al.. 2006. ヒト細胞における薬物のオフターゲット効果および隠された表現型を同定する。 ナット ケム バイオル 2:329–337.Crossref,Medline,CAS,Google Scholar
- 18. Pelletier,J.N.,K.M.Arndt,A.Pluckthun,S.W.Michnick. 1999. 最適化されたタンパク質-タンパク質相互作用のin vivoライブラリ対ライブラリ選択。 ナット バイオテクノール 17:683–690.Crossref,Medline,CAS,Google Scholar
- 19. レミー、I.、I.A.ウィルソン、S.W.Michnick。 1999. リガンド誘導立体配座変化によるエリスロポエチン受容体活性化。 科学283:990-993。Crossref,Medline,CAS,Google Scholar
- 20. Gegg、C.V.、K.E.Bowers、およびC.R.Matthews。 1997. 分子解剖によるジヒドロ葉酸レダクターゼにおける最小の独立した折り畳み単位のプロービング。 プロテインサイク… 6:1885–1892.Crossref,Medline,CAS,Google Scholar
- 21. ロッシ、F.、C.A.チャールトン、H.M.ブラウ。 1997. Β-ガラクトシダーゼ相補性による無傷の真核細胞におけるタンパク質-タンパク質相互作用のモニタリング。 プロク… ナトル アカド サイ… 米国94:8405-8410。Crossref,Medline,CAS,Google Scholar
- 22. 小澤,野上,佐藤,大矢,梅沢,小澤,小澤,小澤,小澤,小澤,小澤,小澤,小澤,小澤,小澤,小澤,小澤,小澤 2000. 蛋白質のスプライシングに基づいて生体内の蛋白質-蛋白質の相互作用を検出するための蛍光指示薬。 アナル… ケム 72:5151–5157.Crossref,Medline,CAS,Google Scholar
- 23. とができることを明らかにした。 2005. 緑の蛍光蛋白質の片の再組み立てのトラップとの蛋白質-蛋白質の相互作用を検出すること:規模およびメカニズム。 J.Am. ケム Soc. 127:146–157.Crossref,Medline,CAS,Google Scholar
- 24. Nyfeler、B.、S.W.Michnick、およびH.P.Hauri。 2005. 生きている細胞の分泌経路におけるタンパク質相互作用を捕捉する。 プロク… ナトル アカド サイ… 米国102:6350-6355。Crossref,Medline,CAS,Google Scholar
- 25. アーント、K.M.、J.N.Pelletier、K.M.Muller、T.Alber、S.W.Michnick、A.Pluckthun。 2000. 設計されたライブラリ対ライブラリアンサンブルからin vivoで選択されたヘテロ二量体コイルコイルペプチドペア。 J.モル。 バイオル 295:627–639.Crossref,Medline,CAS,Google Scholar
- 26. レミー、I.とS.W.Michnick。 2004. プロテインキナーゼB/Aktの新しいモジュレーターであるFt1タンパク質によるアポトーシスの調節。 モル セル バイオル 24:1493–1504.Crossref,Medline,CAS,Google Scholar
- 27. Ding,Z.,J.Liang,Y.Lu,Q.Yu,Z.Songyang,S.Y.Lin,およびG.B.Mills. 2006. レトロウイルスベースのタンパク質相補アッセイ画面は、機能AKT1結合パートナーを明らかにする。 プロク… ナトル アカド サイ… USA 103:15014–15019.Crossref, Medline, CAS, Google Scholar
- 28. Cody, V., J.R. Luft, E. Ciszak, T.I. Kalman, and J.H. Freisheim. 1992. Crystal structure determination at 2.3 A of recombinant human dihydrofolate reductase ternary complex with NADPH and methotrexate-gamma-tetrazole. Anticancer Drug Des. 7:483–491.Medline, CAS, Google Scholar