Anvendelse av protein-fragment komplementeringsanalyser i cellebiologi
- Introduksjon
- Prinsipp
- Begrensninger
- Standardkontroller For En PCA-Studie
- Anvendelse AV PCA I Protein Design: Bibliotek vs. Bibliotek Screening For Optimalt Samvirkende Proteiner
- Anvendelse AV PCA til cDNA Bibliotek Screening I Pattedyrceller
- Bruk AV PCA som Molekylær Linjal: Reseptorstudier
- Kartlegging Biokjemiske Nettverk
- Konklusjon
- Anerkjennelser
Introduksjon
Biokjemiske veier er egentlig systemer for dynamisk montering og demontering av proteinkomplekser, og dermed er mye av moderne biologisk forskning opptatt av hvordan, når og hvor proteiner interagerer med andre proteiner involvert i biokjemiske prosesser. Etterspørselen etter enkle tilnærminger for å studere protein-protein-interaksjoner, spesielt i stor skala, har vokst nylig med fremdriften i genomprosjekter, siden assosiering av ukjent med kjente genprodukter gir en avgjørende måte å etablere funksjonen til et gen. Det var med denne utfordringen i tankene at vårt laboratorium utviklet protein-fragment complementation assays (PCAs). I denne strategien er to proteiner av interesse (proteiner A Og B) smeltet sammen til komplementære fragmenter av et reporterprotein(et enzym, fluorescerende protein, etc.). Hvis proteinene A og B interagerer, blir reporterfragmentene samlet sammen, brettet inn i reporterens opprinnelige struktur og rekonstituert sin aktivitet (Figur 1). PCA reporter proteiner har blitt valgt som de som produserer en rekke påvisbare aktiviteter, inkludert fluorescerende, luminescerende og kolorimetriske signaler, samt enkle overlevelsesvalgsanalyser (1-14). VI har vist AT pca-strategien har følgende evner: (i) det tillater deteksjon av protein – protein-interaksjoner in vivo og in vitro i enhver celletype; (ii) det tillater deteksjon av protein-protein-interaksjoner i passende subcellulære rom eller organeller; (iii) det tillater deteksjon av interaksjoner som er spesifikt indusert som respons på utviklings -, ernæringsmessige, miljømessige eller hormoninducerte signaler; (iv) det tillater overvåking av kinetiske og likevektsaspekter av proteinmontering i celler; og (v) det tillater screening for nye protein-protein-interaksjoner i enhver celletype (2,3,6,9) (15-19).
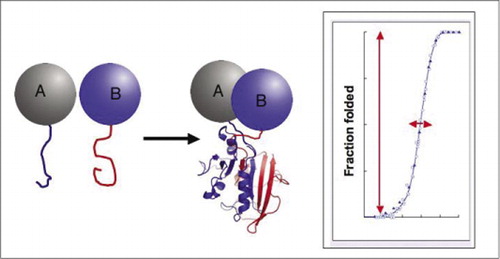
hvis de to proteinene interagerer, blir reporterfragmentene samlet sammen, brett inn i den innfødte strukturen av reporterproteinet, og dets aktivitet rekonstitueres (venstre). Disse protein-fragment complementation assays (PCAs) har fysiske egenskaper som gjør dem spesielt nyttige som journalister av dynamiske proteinkomplekser. Til høyre er en proteinfoldingskurve hvor x-aksen er noen variabel parameter (f. eks., konsentrasjon av ett fragment i forhold til et annet). Den høye kooperativiteten til denne prosessen (ekstremt kraftig økning i brøkdel av brettede arter over et svært smalt område) betyr at analysene har et enormt dynamisk område, noe som gjør deteksjon av et kompleks til et virtuelt alt-eller-ingen-fenomen. Dette står i kontrast til metoder som fluorescensresonans energioverføring (FRET), som har svært lavt dynamisk område og krever nøye optimalisering av en rekke parametere. I motsetning til dette er måling av proteinkompleksdannelse ved PCA ikke vanskeligere enn måling av aktiviteten til det intakte reporterenzymet.
Prinsipp
vi demonstrerte prinsippet OM PCA som startet med enzymet dihydrofolatreduktase (DHFR) som reporter (1). Det var åpenbart at hvis foldingen av enzymet fra dets fragmenter (som detektert ved rekonstituering av aktivitet) var helt avhengig av bindingen sammen av de samvirkende proteiner, så er det beskrevne systemet faktisk en detektor av interaksjonene. Vi og andre har siden vist at dette prinsippet kan generaliseres til en rekke enzymer, inkludert Gaussia og Renilla luciferaser, TEM β-laktamase, samt grønt fluorescerende protein (GFP) og dets varianter (1-14). Et viktig trekk VED pca-fragmenter er at DE er utformet for ikke å kaste seg spontant uten å bli brakt i nærheten av samspillet mellom proteinene de smeltes sammen med (1,20). Hvis spontan folding oppstod, VILLE PCA ganske enkelt ikke fungere. Spontan folding ville føre til et falskt kjøpssignal, en situasjon som håpløst ville forvirre tolkningen av biblioteksskjermer in vivo (forventet å være en viktig applikasjon). I motsetning TIL PCA finnes det analysesystemer basert på β-galaktosidase og splitt inteins som ligner PCA, men som er konseptuelt og praktisk forskjellig (21,22). I begge tilfeller er kjente naturlig forekommende og spontant assosierende underenheter av enzymer smeltet sammen til interagerende proteiner. Det sentrale problemet her er at underenheter, selv om de er svake assosierende, alltid er i stand til å gjøre det til en viss grad, noe som betyr at det er en konstant bakgrunn av spontan montering.
Begrensninger
PCA-strategien er generell, i den forstand at DEN ikke er begrenset til en enkelt enzymreporter, og den har blitt utarbeidet i flere forskjellige former, som hver er best egnet til å løse et bestemt spørsmål. For eksempel, enkel overlevelse-utvalg PCAs, slik som de som er basert PÅ DHFR, er mest nyttig for bibliotek utvalg, mens luminescens Eller fluorescens avlesning PCAs er best for studier av den romlige og tidsmessige dynamikken i proteinkomplekser. Fordi fusjonsproteinene kan uttrykkes i celler som er relevante modeller for å studere en bestemt biokjemisk vei, er de sannsynligvis i sin opprinnelige biologiske tilstand, inkludert de riktige posttranslasjonelle modifikasjonene (åpenbart MÅ PCA-fragmentene selv ikke forstyrre målretting eller modifikasjon av proteinene, og dette må testes).
blant de enkleste Og derfor mest populære Pcaene er De basert på fluorescerende proteiner (SOM GFP og varianter), fordi signalet er gitt av den indre fluoroforen (7-9) (14,15,17,23). Fluorescerende proteiner må imidlertid uttrykkes ved høye nivåer for å sikre at signalet er over bakgrunnscellulær fluorescens, og fluorescerende protein-Pcaer har vist seg å være irreversible, noe som kan være nyttig (fangst og visualisering av sjeldne komplekser), men kan også føre til feilfortolkning av omsetning eller lokalisering av interagerende proteiner (8,23,24). På den annen side har Pcaer basert PÅ DHFR og β-laktamase som reportere, basert på indirekte bevis, vist seg å være reversible etter forstyrrelse av interaksjoner, mens EN PCA basert På Gaussia luciferase har vist seg direkte å være reversibel (2,3,6). Reversibilitet AV PCA tillater dermed deteksjon av kinetiske og likevektsaspekter av proteinkompleksmontering og demontering i levende celler (Figur 2).
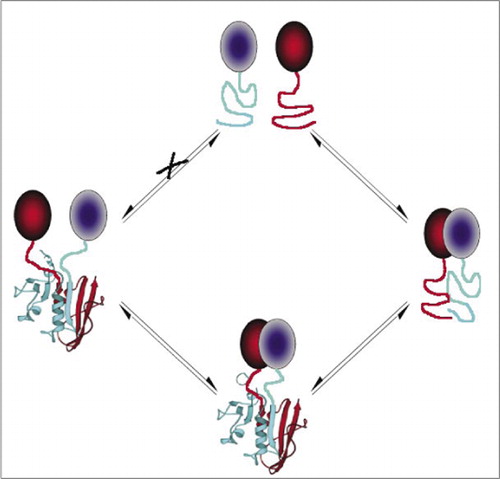
dette forhindrer spontan forening av fragmentene (vei X) som kan føre til et falskt signal. På samme måte velges fragmenter for hvilke spontan utfoldelse av fragmenter skal oppstå når proteinkomplekset forstyrres (venstre side).
Standardkontroller For En PCA-Studie
PCA-strategien krever at fragmentene av reporterproteinet samles og brettes etter at proteinene av interesse har dannet et kompleks. Montering og korrekt folding av reporteren er avhengig av utvinningen av både strukturell geometri iboende til reporterproteiner og av komplekset dannet av de interagerende proteiner. Dette er en av de store forskjellene I pca-analysene sammenlignet med fluorescens resonans energioverføring (FRET) eller bioluminescens resonans energioverføring (BRET) eller gjær to-hybrid-analyser, og denne funksjonen tillot oss å utføre en strukturbasert studie av erytropoietin reseptoren (19). Vi setter vanligvis inn en 10-aminosyre fleksibel polypeptid linker bestående av (Gly.Gly.Gly.Gly.Ser) 2 mellom protein av interesse og PCA reporter fragment(for begge fusjoner). Denne linkeren ble valgt fordi den er mest fleksibel mulig, og vi har empirisk observert at linkere av denne lengden er tilstrekkelig lange til at fragmenter kan finne hverandre og kaste seg, uavhengig av størrelsen på de interagerende proteiner som fragmentene smeltes sammen (16).
for å sikre at ikke-spesifikke responser ikke forekommer, bør et sett med kontroller utføres. Disse kontrollene kan inkludere følgende, selv om den første er den viktigste: (i) Ikke-interagerende proteiner. EN pca-respons bør ikke observeres hvis ikke-interagerende proteiner brukes SOM pca-partnere; overuttrykk av et ikke-interagerende protein alene bør heller ikke konkurrere om den kjente interaksjonen. (ii) Mutasjoner Av Partnerproteingrensesnitt. Et punkt eller sletting mutasjon av en partner som er kjent for å forstyrre en interaksjon bør også hindre EN PCA respons. (iii) Konkurranse. EN pca-respons bør reduseres ved samtidig overuttrykk av det ene eller det andre av de interagerende proteiner som ikke er smeltet sammen med et komplementært PCA-fragment. (iv) Fragment bytte. En observert interaksjon mellom to proteiner bør oppstå selv om proteinene byttes med de respektive reporterfragmentene.
Anvendelse AV PCA I Protein Design: Bibliotek vs. Bibliotek Screening For Optimalt Samvirkende Proteiner
Blant de første anvendelser AV EN PCA var et protein design problem. DHFR PCA-analysen ble brukt I Escherichia coli for å skjerme to biblioteker med komplementært utformede leucin glidelåsdannende sekvenser med 1010 potensielle interaksjonspar, hvorav vi praktisk talt kunne dekke 106. VI viste AT PCA skjermen valgt for både optimal binding spesifisitet, samt løselighet og uttrykk for samspill glidelåser (18,25). Det viktigste ved denne tilnærmingen er at det var mulig å samtidig skjerme to biblioteker mot hverandre, en prosess som ikke lett oppnås med sammenlignbare gjær-to-hybridskjermer. Enkelheten i denne tilnærmingen og spesifikk natur av informasjonen som er oppnådd om designstrategien, tyder på bred nytte AV DHFR PCA i proteindesign og rettede evolusjonseksperimenter. Det viser også AT PCA utfyller fag display strategier, siden hele utvalget, optimalisering, og stringens tester er gjort in vivo, noe som gjør denne tilnærmingen enkelt utført.
Anvendelse AV PCA til cDNA Bibliotek Screening I Pattedyrceller
et første skritt i å definere funksjonen til et nytt genprodukt er å bestemme dets interaksjoner med andre genprodukter. Imidlertid er en rent proteininteraksjonsbasert screeningmetode (som gjær to-hybrid) begrenset, fordi den bare forteller deg at to proteiner interagerer, mens de ikke gir annen informasjon som kan knytte et protein til dets funksjon. DERFOR har VI vist AT PCA kan brukes i en cDNA bibliotek screening strategi som kombinerer en enkel cellebasert protein interaksjon skjerm med spesifikke funksjonelle analyser som gir første validering av den biologiske relevansen av samspillet (9). Det første trinnet består av screening for fysiske interaksjoner mellom agn og et bibliotek av cDNA-kodede bytteproteiner, ved å overvåke rekonstitueringen AV PCA-reporteren i intakte levende celler. Et viktig trekk ved dette første trinnet er at interaksjoner kan oppdages direkte og mellom full lengde proteiner i celler der agnproteinet normalt fungerer, og dermed sikre at nødvendig subcellulær målretting, posttranslasjonelle modifikasjoner og interaksjoner med andre proteiner kan forekomme. Åpenbart, for eksperimentell validitet, MÅ PCA-fragmentene demonstreres for ikke å forstyrre målretting eller modifikasjon av proteinene. I det andre trinnet kan proteininteraksjonen funksjonelt valideres, som følger: først må proteininteraksjonen, oppdaget AV PCA, forstyrres av midler, som hormoner eller spesifikke hemmere, som er kjent for å modulere den spesifikke biokjemiske banen der proteinene deltar. Vi har demonstrert dette FOR DHFR PCA og brukt denne egenskapen til å kartlegge signalveier i levende pattedyrceller (16). For det andre kan den subcellulære lokaliseringen av proteininteraksjonen, igjen oppdaget AV PCA, endres av midler som modulerer banen. DERMED KOMBINERER den PCA-baserte screeningstrategien et enkelt screeningstrinn med direkte funksjonelle analyser. Vi og andre har brukt denne strategien til identifisering av nye substrater eller regulatorer av serin / treonin proteinkinase, PKB / Akt (9,15,26,27).
Bruk AV PCA som Molekylær Linjal: Reseptorstudier
et spesielt trekk VED PCA-strategier er at hvis VI kjenner den tredimensjonale strukturen til reporterenzymet, er det mulig å forutsi nøyaktig hvor tett sammen fragmentene må være for å sikre at enzymet vil foldes riktig og ha en målbar aktivitet. Dette faktum ble satt i arbeid for å teste en strukturell allosterisk modell for aktivering av dimeric erytropoietin receptor (EpoR) ved HJELP AV DHFR PCA, og tilnærmingen kan utvides til å studere allosteriske overganger i dimeric eller multimeric protein grensesnitt (19). I epor-tilfellet ble det vist at reseptordimer-transmembrane domener ble separert med 73 Å, som observert i krystallstrukturen til unligated EpoR. DET ble begrunnet at hvis denne inaktive tilstanden eksisterte på membranen til en levende celle, VILLE DHFR-fragmenter smeltet Til c-termini av de transmembrane domenene bare foldes hvis en ligand induserte en konformasjonsendring som tillater fragmentene å komme nær nok sammen for å sikre at DEN nøyaktige tredimensjonale strukturen AV DHFR kunne dannes (19,28). Dette ville kreve At N termini av fragmentene være 8 Å fra hverandre. Innsetting av fleksible linkerpeptider mellom transmembran-domenet og DHFR-fragmentene tillot oss å undersøke avstanden mellom innsettingspunktene til det ekstracellulære domenet dimer og bekrefte at linkere lenge nok til å strekke seg over 73 Å var nødvendig for DHFR å kaste seg fra fragmentene.
Kartlegging Biokjemiske Nettverk
Cellulære biokjemiske machineries for metabolisme, signalering kaskader, og celle syklus er eksempler på dynamisk montering og demontering makromolekylære komplekser. Disse defineres ved å gruppere samvirkende proteiner i henhold til deres lignende respons på et sett av forstyrrelser(hormoner, metabolitter, enzymhemmere, etc.). Protein-protein interaksjoner kan brukes til å koble et protein av ukjent funksjon til proteiner som er kjent for å være involvert i en kjent biokjemisk prosess. Vi har vist at farmakologisk profilering (overvåking av effekter av banespesifikke legemidler og proteinhormoner på protein-protein-interaksjoner) og bestemmelse av cellulær plassering av protein-protein-interaksjoner kan oppnås ved Bruk Av PCAs (9)(15-17)(26). Analyse av disse resultatene tillater en representasjon av hvordan biokjemiske nettverk utvikler seg i tid og rom og som svar på spesifikke stimuli. Som et prinsippbevis rapporterte vi anvendelsen av denne strategien til kartlegging av en signaltransduksjonsvei mediert av reseptortyrosinkinaser (RTKs) (16). De farmakologiske profilene og den cellulære plasseringen av interaksjoner vi observerte tillot oss å plassere hvert genprodukt på sitt relevante punkt i veiene (Figur 3). Fra resultatene av vår analyse dukket opp et kart over organisasjonen AV RTK-nettverket som var i samsvar med eksisterende modeller, men som også inkluderte flere nye interaksjoner. Evnen til å overvåke et nettverk av proteininteraksjoner i levende celler som inneholder alle komponentene i den underliggende banen som ble studert, viste skjulte forbindelser, ikke observert før, til tross for intens granskning av dette nettverket. Resultatene som presenteres viser AT PCA-strategien har de funksjonene som er nødvendige for en generell genfunksjonsvalidering og banekartleggingsstrategi. En nylig anvendelse av et større Sett Med Pcaer gjorde det mulig å utvikle en generell tilnærming for å knytte stoffers handlinger på bestemte signalveier og å oppdage uforutsette aktiviteter av narkotika (17).
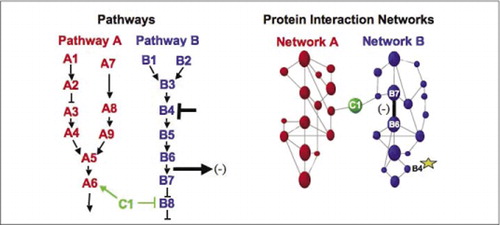
(Venstre) virkningen av et hemmende perturbasjonsmiddel som virker på protein B4 (T-bar), oppdages nedstrøms ved en endring i samspillet mellom proteiner B6 Og B7 med hverandre (pil). I dette tilfellet er effekten av forstyrrelsen en reduksjon i antall interagerende protein ( – ) som oppdaget av en reporter av den interaksjonen(utgangssignal av interaksjonen som oppdaget AV PCA sentinel for eksempel). Effekten kan imidlertid også være positiv, avhengig av konsekvensene av å hemme oppstrømsproteinet. (Høyre) Innenfor proteininteraksjonsnettverket for vei B, forplanter en forstyrrelse av protein B4 (stjerne) på en eller annen måte gjennom nettverket for å påvirke koblingen (bred bar) mellom proteiner B6 og B7. Dette betyr ikke at protein B4 fysisk interagerer med Enten B6 eller B7; forplantningen av en påvirkning gjennom proteininteraksjonsnettverket kan skyldes direkte fysiske koblinger eller til enzymatiske prosesser som ikke er åpenbare i nettverket.
Konklusjon
utvikling og anvendelse AV PCA pågår fortsatt. For eksempel, i tillegg til de begrensede, men informative, settene med applikasjoner som er beskrevet her, blir strategien brukt på storskala screening av hele genomer. Mer sofistikerte problemer med protein design og protein folding blir utforsket, inkludert studier av faktorer som styrer valg av sekvenser for optimale interaksjoner mellom proteiner, proteiner og nukleinsyrer, og proteiner og små organiske molekyler. PCA er en svært generell og fleksibel eksperimentell tilnærming, og dermed bør vi forvente å se et økende antall nye anvendelser av dette grunnleggende verktøyet til molekylær-og cellebiologi i nær fremtid.
Anerkjennelser
Stephen Michnick holder Canada Research Chair I Integrative Genomics. Forskning sitert fra vårt laboratorium ble finansiert av Canadian Institutes Of Health Research.
- 1. Han er en av de eldste i Verden. 1998. Oligomerisering domene-rettet reassembly av aktiv dihydrofolat reduktase fra rasjonelt utformet fragmenter. Proc. Natl. Acad. Sci. USA 95: 12141-12146.Crossref, Medline, CAS, Google Scholar
- 2. Remy, I. Og S. W. Michnick. 1999. Klonal seleksjon og in vivo kvantifisering av proteininteraksjoner med proteinfragmentkomplementstester. Proc. Natl. Acad. Sci. USA 96: 5394-5399.Crossref, Medline, CAS, Google Scholar
- 3. Det er en av de mest kjente artene i verden. 2002. Beta-laktamase proteinfragment komplement analyser som in vivo og in vitro sensorer av protein protein interaksjoner. Nat. Bioteknologi. 20:619–622.Crossref, Medline, CAS, Google Scholar
- 4. I tillegg til å være en del av det norske samfunnet, er det en del av det norske samfunnet. 2002. Protein – protein-interaksjoner overvåkes i pattedyrceller via komplementering av beta-laktamase – enzymfragmenter. Proc. Natl. Acad. Sci. USA 99:3469-3474.Crossref, Medline, CAS, Google Scholar
- 5. Det er en av de mest kjente artene i verden. 2002. Time-lapse imaging av en dynamisk fosforyleringsavhengig protein-protein-interaksjon i pattedyrceller. Proc. Natl. Acad. Sci. USA 99: 15142-15147.Crossref, Medline, CAS, Google Scholar
- 6. Remy, I. Og S. W. Michnick. 2006. En svært sensitiv protein-protein interaksjonstest basert På Gaussia luciferase. Nat. Metoder 3: 977-979.Crossref, Medline, CAS, Google Scholar
- 7. Ghosh, I., A. D. Hamilton og L. Regan. 2000. Antiparallel leucin glidelås-rettet protein reassembly: søknad til den grønne fluorescerende protein. J. Am. Chem. Soc. 122:5658–5659.Crossref, CAS, Google Scholar
- 8. Han er en av de eldste i Verden. 2002. Visualisering av interaksjoner mellom bzip og Rel familie proteiner i levende celler ved hjelp av bimolekylær fluorescens komplementering. Mol. Celle 9:789-798.Crossref, Medline, CAS, Google Scholar
- 9. Remy, I. Og S. W. Michnick. 2004. En cDNA bibliotek funksjonell screening strategi basert på fluorescerende protein komplement analyser for å identifisere nye komponenter av signalveier. Metoder 32: 381-388.Crossref, Medline, CAS, Google Scholar
- 10. I tillegg til å være en av de mest kjente artene i verden, er det mange som er interessert i dette. 2005. Påvisning av protein interaksjoner og bibliotek screening med protein-fragment komplement analyser, s. 637-672. I Protein-Protein Interaksjoner: En Molekylær Kloning Manuell, 2.utg. Hotell I Nærheten Av Csh Laboratory Press, Cold Spring Harbor, NYGoogle Scholar
- 11. Paulmurugan, R. Og S. S. Gambhir. 2003. Overvåking av protein-protein-interaksjoner ved bruk av split syntetisk renilla luciferase protein-fragmentassistert komplementering. Anal. Chem. 75:1584–1589.Crossref, Medline, CAS, Google Scholar
- 12. Det er en av de mest kjente artene i verden. 2002. Ikke-invasiv avbildning av protein-protein-interaksjoner hos levende personer ved hjelp av reporterproteinkomplementasjons-og rekonstitueringsstrategier. Proc. Natl. Acad. Sci. USA 99: 15608-15613.Crossref, Medline, CAS, Google Scholar
- 13. I tillegg til dette er det en rekke andre arter. 2004. Kinetikk av regulerte protein-protein interaksjoner avslørt med firefly luciferase komplement imaging i celler og levende dyr. Proc. Natl. Acad. Sci. USA 101:12288-12293.Crossref, Medline, CAS, Google Scholar
- 14. Han er en av de eldste i verden. 2006. En forbedret mRFP1 legger rødt til bimolekylær fluorescens komplementering. Nat. Metoder 3: 597-600.Crossref, Medline, CAS, Google Scholar
- 15. Han er en av de eldste i Verden. 2004. PKB / Akt modulerer TGF-beta-signalering gjennom en direkte interaksjon Med Smad3. Nat. Celle Biol. 6:358–365.Crossref, Medline, CAS, Google Scholar
- 16. Remy, I. Og S. W. Michnick. 2001. Visualisering av biokjemiske nettverk i levende celler. Proc. Natl. Acad. Sci. USA 98: 7678-7683.Crossref, Medline, CAS, Google Scholar
- 17. Macdonald, M. L., J. Lamerdin, S. Owens, B. H. Keon, G. K. Bilter, Z. Shang, Z. Huang, H. Yu, et al.. 2006. Identifisere off-target effekter og skjulte fenotyper av legemidler i humane celler. Nat. Chem. Biol. 2:329–337.Crossref, Medline, CAS, Google Scholar
- 18. Han er en av de eldste i verden. 1999. En in vivo bibliotek-versus-bibliotek utvalg av optimaliserte protein-protein interaksjoner. Nat. Bioteknologi. 17:683–690.Crossref, Medline, CAS, Google Scholar
- 19. Remy, I., I. A. Wilson og S. W. Michnick. 1999. Erytropoietin reseptor aktivering av en ligand-indusert konformasjon endring. Vitenskap 283: 990-993.Crossref, Medline, CAS, Google Scholar
- 20. Gegg, C. V., K. E. Bowers og C. R. Matthews. 1997. Sondering minimal uavhengige folding enheter i dihydrofolat reduktase ved molekylær disseksjon. Protein Sci. 6:1885–1892.Crossref, Medline, CAS, Google Scholar
- 21. Han er en av de eldste i verden. 1997. Overvåking av protein-protein-interaksjoner i intakte eukaryote celler ved beta-galaktosidasekomplementering. Proc. Natl. Acad. Sci. USA 94: 8405-8410.Crossref, Medline, CAS, Google Scholar
- 22. I tillegg til å være en del av det norske samfunnet, er det en del av det norske samfunnet. 2000. En fluorescerende indikator for å oppdage protein-protein-interaksjoner in vivo basert på protein spleising. Anal. Chem. 72:5151–5157.Crossref, Medline, CAS, Google Scholar
- 23. I tillegg til å være en del av det norske samfunnet, er det en del av det norske samfunnet. 2005. Oppdage protein-protein interaksjoner med en grønn fluorescerende protein fragment reassembly felle: omfang og mekanisme. J. Am. Chem. Soc. 127:146–157.Crossref, Medline, CAS, Google Scholar
- 24. Han er en av de eldste i verden. 2005. Fange proteininteraksjoner i sekretorisk vei for levende celler. Proc. Natl. Acad. Sci. USA 102: 6350-6355.Crossref, Medline, CAS, Google Scholar
- 25. I tillegg til å være en del av en rekke av disse 2000. Et heterodimerisk spiralspolepeptidpar valgt in vivo fra et designet bibliotek-versus-bibliotek-ensemble. J. Mol. Biol. 295:627–639.Crossref, Medline, CAS, Google Scholar
- 26. Remy, I. Og S. W. Michnick. 2004. Regulering av apoptose ved ft1-proteinet, en ny modulator av proteinkinase B / Akt. Mol. Celle. Biol. 24:1493–1504.Crossref, Medline, CAS, Google Scholar
- 27. Det er en av de største byene i verden. 2006. En retrovirusbasert proteinkomplementeringsanalyseskjerm avslører funksjonelle AKT1-bindende partnere. Proc. Natl. Acad. Sci. USA 103:15014–15019.Crossref, Medline, CAS, Google Scholar
- 28. Cody, V., J.R. Luft, E. Ciszak, T.I. Kalman, and J.H. Freisheim. 1992. Crystal structure determination at 2.3 A of recombinant human dihydrofolate reductase ternary complex with NADPH and methotrexate-gamma-tetrazole. Anticancer Drug Des. 7:483–491.Medline, CAS, Google Scholar