Solubiologiassa
- Johdanto
- periaate
- rajoitukset
- PCA-tutkimuksen Standardikontrollit
- PCA: n käyttö proteiinin suunnittelussa: kirjasto vs. kirjasto-seulonta optimaalisesti vuorovaikutuksessa olevien proteiinien osalta
- PCA: n soveltaminen cDNA: n Kirjastoseulontaan nisäkässoluissa
- PCA: n käyttäminen Molekulaarisena Viivoittimena: Reseptoritutkimukset
- biokemiallisten verkostojen kartoitus
- päätelmä
- tunnustukset
Johdanto
biokemialliset reitit ovat todellisuudessa systeemejä, joissa proteiinikomplekseja kasataan ja puretaan dynaamisesti, ja siksi suuri osa nykyaikaisesta biologisesta tutkimuksesta käsittelee sitä, miten, milloin ja missä proteiinit ovat vuorovaikutuksessa muiden biokemiallisiin prosesseihin osallistuvien proteiinien kanssa. Kysyntä yksinkertaisista lähestymistavoista proteiinien ja proteiinien vuorovaikutusten tutkimiseksi erityisesti laajamittaisesti on kasvanut viime aikoina genomiprojektien edistymisen myötä, sillä tuntemattoman yhdistäminen tunnettuihin geenituotteisiin on yksi ratkaiseva tapa määrittää geenin toiminta. Tätä haastetta silmällä pitäen laboratoriomme kehitti proteiini-fragmentti-komplementaatiomäärityksiä (PCAS). Tässä strategiassa kaksi kiinnostavaa proteiinia (proteiinit A ja B) fuusioidaan reportteriproteiinin (entsyymi, fluoresoiva proteiini jne.). Jos proteiinit A ja B vuorovaikuttavat keskenään, reportterin fragmentit yhdistyvät, taittuvat reportterin alkuperäiseen rakenteeseen ja aktivoituvat uudelleen (Kuva 1). PCA reporter proteiinit on valittu ne tuottavat erilaisia havaittavia toimintoja, kuten fluoresoiva, luminescent, ja kolorimetriset signaalit, sekä yksinkertainen survival selection assays (1-14). Olemme osoittaneet, että PCA-strategialla on seuraavat ominaisuudet: i) se mahdollistaa proteiinien ja proteiinien välisten interaktioiden havaitsemisen in vivo ja in vitro missä tahansa solutyypissä; ii) se mahdollistaa proteiinien ja proteiinien välisten interaktioiden havaitsemisen sopivissa solukohdissa tai organelleissa; iii) se mahdollistaa sellaisten interaktioiden havaitsemisen, jotka on erityisesti indusoitu vastauksena kehitys -, ravinto -, ympäristö-tai hormonisignaaleihin; iv) se mahdollistaa proteiinien muodostumisen kineettisten ja tasapainoon liittyvien näkökohtien seurannan; ja v) se mahdollistaa uusien proteiinien ja proteiinien interaktioiden seulonnan missä tahansa solutyypissä (2,3,6,9) (15-19).
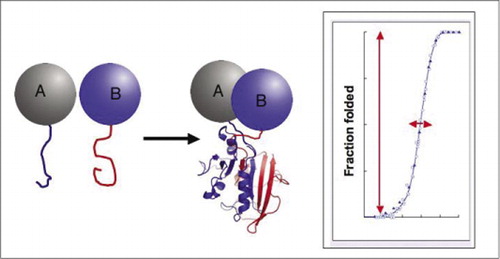
jos kaksi proteiinia vuorovaikuttaa keskenään, reporter-fragmentit yhdistyvät, taittuvat reporter-proteiinin alkuperäiseen rakenteeseen ja sen toiminta rekonstruoituu (vas.). Näillä proteiini-fragment complementation assayillä (PCA) on fysikaalisia ominaisuuksia, jotka tekevät niistä erityisen hyödyllisiä dynaamisten proteiinikompleksien toimittajina. Oikealla on proteiinin taittokäyrä, jossa x-akseli on jokin muuttuva parametri (esim., yhden fragmentin konsentraatio suhteessa toiseen). Tämän prosessin korkea yhteistoiminnallisuus (erittäin jyrkkä kasvu taitettujen lajien murto-osassa hyvin kapealla alueella) tarkoittaa, että määrityksillä on valtava dynaaminen alue, mikä tekee kompleksin havaitsemisesta virtuaalisen kaikki tai ei mitään-ilmiön. Tämä eroaa menetelmistä, kuten fluoresenssin resonanssienergiansiirrosta (FRET), jolla on hyvin alhainen dynaaminen alue ja joka vaatii useiden parametrien huolellista optimointia. Sen sijaan proteiinikompleksin muodostumisen mittaaminen PCA: lla ei ole sen vaikeampaa kuin ehjän reportterientsyymin aktiivisuuden mittaaminen.
periaate
osoitimme PCA: n periaatteen alkaen dihydrofolaattireduktaasientsyymistä (DHFR) toimittajana (1). Oli ilmeistä, että jos entsyymin taitto sen fragmenteista (joka on havaittu aktivoitumalla uudelleen) oli ehdottoman riippuvainen vuorovaikutuksessa olevien proteiinien sitoutumisesta yhteen, niin kuvattu järjestelmä on itse asiassa vuorovaikutusten ilmaisin. Me ja muut olemme sittemmin osoittaneet, että tämä periaate voidaan yleistää useisiin entsyymeihin, kuten Gaussia-ja Renilla-lusiferaaseihin, tem-β-laktamaasiin sekä vihreään fluoresoivaan proteiiniin (GFP) ja sen muunnoksiin (1-14). PCA-fragmenttien keskeinen piirre on se, että ne on suunniteltu siten, että ne eivät taittu spontaanisti joutumatta lähekkäin niiden proteiinien vuorovaikutuksen vuoksi, joihin ne ovat fuusioituneet (1,20). Jos spontaania taittumista tapahtuisi, PCA ei yksinkertaisesti toimisi. Spontaani taitto johtaisi väärään positiiviseen signaaliin, tilanteeseen, joka toivottomasti sekoittaisi kirjaston näyttöjen tulkinnan in vivo (odotetaan olevan tärkeä sovellus). PCA: sta poiketen on β-galaktosidaasiin ja halkaistuihin inteiineihin perustuvia määritysjärjestelmiä, jotka muistuttavat PCA: ta, mutta ovat käsitteellisesti ja käytännössä erilaisia (21,22). Molemmissa tapauksissa tunnetut luonnollisesti esiintyvät ja spontaanisti assosioituvat entsyymien alayksiköt fuusioituvat vuorovaikutuksessa oleviin proteiineihin. Keskeinen ongelma tässä on se, että alayksiköt, vaikka ne heikosti liittyisivätkin, pystyvät aina jossain määrin siihen, mikä tarkoittaa, että taustalla on jatkuva spontaani kokoontuminen.
rajoitukset
kumppanuus-ja YHTEISTYÖSOPIMUSSTRATEGIA on yleinen siinä mielessä, että se ei rajoitu yhteen entsyymitoimittajaan, ja se on laadittu useissa eri muodoissa, joista jokainen soveltuu parhaiten tietyn kysymyksen käsittelyyn. Esimerkiksi yksinkertaiset selviytymisen valinta-PCAs: t, kuten DHFR: ään perustuvat, ovat hyödyllisimpiä kirjaston valinnassa, kun taas luminesenssi tai fluoresenssin lukema-PCAs: t ovat parhaita proteiinikompleksien tila-ja ajallisen dynamiikan tutkimuksissa. Koska fuusioproteiinit voidaan ilmaista soluissa, jotka ovat relevantteja malleja tietyn biokemiallisen reitin tutkimiseksi, ne ovat todennäköisesti alkuperäisessä biologisessa tilassaan, mukaan lukien oikeat translaation jälkeiset muutokset (PCA-fragmentit itsessään eivät tietenkään saa häiritä proteiinien kohdentamista tai muokkaamista, ja tämä on testattava).
yksinkertaisimpia ja siksi suosituimpia PCAs-yhdisteitä ovat fluoresoiviin proteiineihin perustuvat PCAs-yhdisteet (kuten GFP ja variantit), koska signaalin antaa luontainen fluorofori (7-9)(14,15,17,23). Fluoresoivien proteiinien on kuitenkin ilmaistava suurina pitoisuuksina sen varmistamiseksi, että signaali on solujen taustafluoresenssin yläpuolella, ja fluoresoivien proteiinien PCAs-yhdisteiden on osoitettu olevan peruuttamattomia, mikä voi olla hyödyllistä (harvinaisten kompleksien pyydystäminen ja visualisointi), mutta se voi myös johtaa vuorovaikutusproteiinien liikevaihdon tai lokalisoinnin virheelliseen tulkintaan (8,23,24). Toisaalta VÄLITTÄJÄAINEINA DHFR: ään ja β-laktamaasiin perustuvat PCA: t ovat epäsuoran näytön perusteella osoittautuneet palautuviksi interaktioiden katkeamisen jälkeen, kun taas Gaussia-lusiferaasiin perustuva PCA on suoraan osoitettu palautuviksi (2, 3, 6). PCA: n palautuvuus mahdollistaa näin ollen proteiinikompleksien kokoamiseen ja purkamiseen elävissä soluissa liittyvien kineettisten ja tasapainonäkökohtien havaitsemisen (kuva 2).
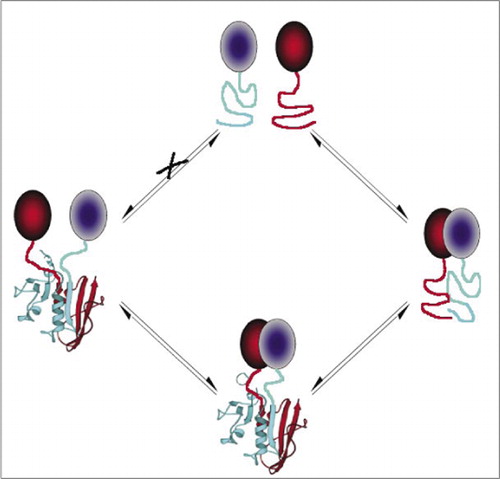
tämä estää palasten spontaanin yhdistymisen (reitti X), joka voi johtaa väärään signaaliin. Samoin valitaan fragmentteja, joille fragmenttien spontaanin avautumisen pitäisi tapahtua, kun proteiinikompleksi häiriintyy (vasen puoli).
PCA-tutkimuksen Standardikontrollit
PCA-strategia edellyttää, että toimittajaproteiinin fragmentit kokoontuvat ja taittuvat sen jälkeen, kun kiinnostavat proteiinit ovat muodostaneet kompleksin. Reportterin kokoonpano ja oikea taittuminen riippuu sekä reportteriproteiineille luontaisen rakennegeometrian että vuorovaikuttavien proteiinien muodostaman kompleksin palautumisesta. Tämä on yksi PCA-määritysten tärkeimmistä eroavaisuuksista verrattuna fluoresenssiresonanssienergiansiirtoon (FRET) tai bioluminesenssien resonanssienergiansiirtoon (BRET) tai hiivan kaksihybridimäärityksiin, ja tämän ominaisuuden ansiosta pystyimme suorittamaan erytropoietiinireseptorin rakenteeseen perustuvan tutkimuksen (19). Lisäämme tyypillisesti 10-aminohapon joustavan polypeptidilinkerin, joka koostuu (Gly.Gly.Gly.Gly.Ser) 2 välillä proteiini kiinnostaa ja PCA reporter fragmentti (molemmat fuusiot). Tämä linkkeri valittiin, koska se on joustavin mahdollinen, ja olemme empiirisesti havainneet, että tämän pituiset linkerit ovat riittävän pitkiä, jotta fragmentit löytävät toisensa ja taittuvat, riippumatta niiden vuorovaikuttavien proteiinien koosta, joihin fragmentit fuusioituvat (16).
sen varmistamiseksi, että epäspesifisiä vasteita ei ilmene, on suoritettava kontrolliryhmä. Nämä kontrollit voivat sisältää seuraavia, vaikka ensimmäinen on tärkein: i) ei-vuorovaikutuksessa olevat proteiinit. PCA-vastetta ei pitäisi havaita, jos PCA-kumppaneina käytetään ei-vuorovaikutuksessa olevia proteiineja; pelkkä ei-vuorovaikutteisen proteiinin yliekspressio ei myöskään saisi kilpailla tunnetusta yhteisvaikutuksesta. (ii) Partner protein interface mutations. Partnerin piste-tai deleetiomutaation, jonka tiedetään häiritsevän vuorovaikutusta, pitäisi myös estää PCA-vaste. III) kilpailu. PCA-vastetta pitäisi vähentää jommankumman vuorovaikuttavan proteiinin samanaikainen yliekspressio, joka ei ole fuusioitunut komplementaariseen PCA-fragmenttiin. iv) fragmenttien vaihto. Havaittu vuorovaikutus kahden proteiinin välillä tulisi tapahtua, vaikka proteiinit vaihtuisivat vastaaviin reporter-fragmentteihin.
PCA: n käyttö proteiinin suunnittelussa: kirjasto vs. kirjasto-seulonta optimaalisesti vuorovaikutuksessa olevien proteiinien osalta
PCA: n ensimmäisiä sovelluksia oli proteiinin suunnitteluongelma. DHFR PCA-määritystä käytettiin Escherichia coli-bakteerissa kahden täydentävästi suunnitellun leusiinin vetoketjumuodostussarjan seulomiseen 1010 potentiaalisella vuorovaikutusparilla, joista voisimme käytännössä kattaa 106. Osoitimme, että PCA-näyttö on valittu sekä optimaaliseen sitovaan spesifisyyteen että vuorovaikutteisten vetoketjujen liukoisuuteen ja ilmentymiseen (18,25). Tärkein piirre tässä lähestymistavassa on, että se oli mahdollista samanaikaisesti näytön kaksi kirjastoa toisiaan vastaan, prosessi ei helposti saavuteta vastaavilla hiiva kaksi-hybridi näytöt. Tämän lähestymistavan yksinkertaisuus ja suunnittelustrategiasta saatujen tietojen erityisluonne viittaavat DHFR PCA: n laajaan hyötykäyttöön proteiinien suunnittelussa ja suunnatuissa evoluutiokokeissa. Se osoittaa myös, että PCA täydentää phage-näyttöstrategioita, koska koko valinta -, optimointi-ja tiukkuustestit tehdään In vivo, joten tämä lähestymistapa on helppo toteuttaa.
PCA: n soveltaminen cDNA: n Kirjastoseulontaan nisäkässoluissa
ensimmäinen askel uuden geenituotteen tehtävän määrittelyssä on määrittää sen vuorovaikutus muiden geenituotteiden kanssa. Puhtaasti proteiinien vuorovaikutukseen perustuva seulontamenetelmä (kuten hiivakaksikko-hybridi) on kuitenkin rajallinen, koska se kertoo vain kahden proteiinin vuorovaikutuksesta, mutta ei tarjoa mitään muuta tietoa, joka voisi yhdistää proteiinin sen toimintaan. Tämän vuoksi olemme osoittaneet, että PCA: ta voidaan käyttää cDNA-kirjaston seulontastrategiassa, jossa yhdistetään yksinkertainen solupohjaisten proteiinien vuorovaikutusseula erityisiin funktionaalisiin määrityksiin, jotka antavat alustavan validoinnin vuorovaikutuksen biologiselle merkityksellisyydelle (9). Ensimmäisessä vaiheessa seulotaan syöttien ja cDNA-koodattujen saalisproteiinien kirjaston väliset fyysiset vuorovaikutukset seuraamalla PCA-ilmoittajan uudelleensijoittumista ehjiin eläviin soluihin. Tärkeä piirre tässä ensimmäisessä vaiheessa on se, että yhteisvaikutuksia voidaan havaita suoraan ja täyspitkien proteiinien välillä soluissa, joissa syöttiproteiini normaalisti toimii, varmistaen näin, että tarvittavia solunalaisia kohdistuksia, translaation jälkeisiä muutoksia ja yhteisvaikutuksia muiden proteiinien kanssa voi esiintyä. Kokeellista validiteettia varten on tietenkin osoitettava, etteivät PCA-fragmentit häiritse proteiinien kohdentamista tai muuntamista. Toisessa vaiheessa proteiinien vuorovaikutus voidaan toiminnallisesti validoida seuraavasti: ensinnäkin PCA: n havaitsemaa proteiinien vuorovaikutusta on häirittävä aineilla, kuten hormoneilla tai spesifisillä estäjillä, joiden tiedetään moduloivan spesifistä biokemiallista reittiä, johon proteiinit osallistuvat. Olemme osoittaneet tämän DHFR PCA: lle ja käyttäneet tätä ominaisuutta kartoittaaksemme signalointireittejä elävissä nisäkässoluissa (16). Toiseksi, PCA: n havaitsema proteiinin vuorovaikutuksen subsellulaarinen lokalisaatio saattaa muuttua reittiä moduloivilla aineilla. PCA-pohjaisessa seulontastrategiassa yhdistetään yksinkertainen seulontavaihe suoriin toiminnallisiin määrityksiin. Me ja muut olemme soveltaneet tätä strategiaa seriini-treoniiniproteiinikinaasin PKB/Akt (9,15,26,27) uusien substraattien tai säätelijöiden tunnistamiseen.
PCA: n käyttäminen Molekulaarisena Viivoittimena: Reseptoritutkimukset
PCA-strategioiden erityispiirre on se, että jos tiedämme raportoivan entsyymin kolmiulotteisen rakenteen, on mahdollista ennustaa tarkasti, kuinka lähellä toisiaan fragmenttien on oltava, jotta entsyymi taittuu oikein ja sillä on mitattavissa oleva aktiivisuus. Tätä tosiasiaa käytettiin dimeerisen erytropoietiinireseptorin (EpoR) aktivoinnin rakenteellisen allosteerisen mallin testaamiseen DHFR PCA-menetelmällä, ja lähestymistapaa voitaisiin laajentaa allosteeristen siirtymien tutkimiseen dimeerisissä tai multimeerisissä proteiinirajapinnoissa (19). Eporin tapauksessa reseptoridimeerin transmembraanidomeenien osoitettiin olevan toisistaan erillään 73 Å, mikä on havaittu uskonnottoman Eporin kiderakenteessa. Ajateltiin, että jos tämä inaktiivinen tila olisi olemassa elävän solun kalvolla, TRANSMEMBRAANIDOMEENIEN C-termiiniin fuusioituneet DHFR-fragmentit taittuisivat vain, jos ligandi aiheuttaisi konformaatiomuutoksen, jonka ansiosta fragmentit pääsisivät riittävän lähelle toisiaan, jotta DHFR: n tarkka kolmiulotteinen rakenne voitaisiin muodostaa (19,28). Tämä edellyttäisi, että palasten N termini olisi 8 Å: n päässä toisistaan. Joustavien linker-peptidien lisääminen transmembrane-domeenin ja DHFR-fragmenttien väliin antoi meille mahdollisuuden tutkia solunulkoisen domeenin dimeerin insertiopisteiden välistä etäisyyttä ja vahvistaa, että DHFR: n taittumiseen fragmenteista tarvittiin tarpeeksi pitkiä linkereitä 73 Å: een asti.
biokemiallisten verkostojen kartoitus
solujen biokemialliset koneet aineenvaihduntaa, signalointikaskadeja ja solusykliä varten ovat esimerkkejä makromolekyylikompleksien dynaamisesti kokoamisesta ja purkamisesta. Nämä määritellään ryhmittämällä vuorovaikutuksessa olevat proteiinit niiden samankaltaisen vasteen mukaan häiriöille (hormonit, metaboliitit, entsyymin estäjät jne.). Proteiini-proteiini-interaktioita voidaan käyttää yhdistämään tuntematon proteiini proteiineihin, joiden tiedetään osallistuvan tunnettuun biokemialliseen prosessiin. Olemme osoittaneet, että farmakologinen profilointi (reittispesifisten lääkkeiden ja proteiinihormonien vaikutusten seuranta proteiini-proteiini-vuorovaikutuksiin) ja proteiini-proteiini-yhteisvaikutusten solukohtaisen sijainnin määrittäminen voidaan saavuttaa PCAs: n avulla.(9)(15-17)(26). Näiden tulosten analysointi mahdollistaa kuvauksen siitä, miten biokemialliset verkostot kehittyvät ajassa ja avaruudessa ja reagoivat tiettyihin ärsykkeisiin. Periaatteen osoituksena raportoimme tämän strategian soveltamisesta reseptorityrosiinikinaasien (RTKs) (16) välittämän signaalinsiirtoreitin kartoitukseen. Havaitsemiemme farmakologisten profiilien ja solukohtaisten interaktioiden avulla pystyimme sijoittamaan jokaisen geenituotteen sen tärkeään kohtaan reitillä (kuva 3). Analyysimme tuloksista syntyi RTK-verkoston organisaatiokartta, joka oli yhdenmukainen olemassa olevien mallien kanssa, mutta joka sisälsi myös useita uusia vuorovaikutussuhteita. Kyky seurata elävissä soluissa olevien proteiinien vuorovaikutuksia sisältävää verkostoa, joka sisältää kaikki tutkittavan reitin osat, paljasti piileviä yhteyksiä, joita ei ole havaittu aiemmin, vaikka tätä verkostoa on tutkittu intensiivisesti. Esitetyt tulokset osoittavat, että PCA-strategiassa on geenitoimintojen yleisen validointi-ja polkukartoitusstrategian edellyttämät ominaisuudet. Äskettäin käyttöön otettu laajempi kumppanuus-ja yhteistyösopimus mahdollisti sellaisen yleisen lähestymistavan kehittämisen, jonka avulla voidaan yhdistää huumausaineiden vaikutukset tiettyihin signalointireitteihin ja havaita huumausaineiden ennakoimattomat toimet (17).
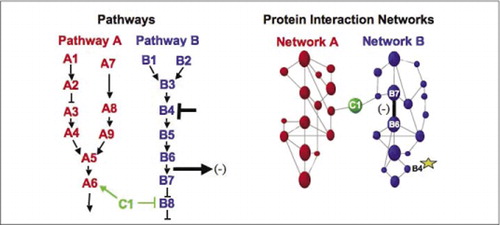
(vas.) proteiini B4: ään vaikuttavan inhiboivan häiritsevän aineen (T-bar) vaikutus havaitaan virtaussuuntaan proteiinien B6 ja B7 keskinäisen vuorovaikutuksen muutoksella (arrow). Tässä tapauksessa häiriön vaikutus on vuorovaikutteisen proteiinin (-) määrän väheneminen, jonka kyseisen vuorovaikutuksen toimittaja havaitsee (esimerkiksi PCA Sentinelin havaitsema vuorovaikutuksen lähtösignaali). Vaikutus voi kuitenkin yhtä lailla olla positiivinen riippuen siitä, mitä seurauksia on alkuproteiinin estämisestä. (Oikealla) B-reitin proteiiniverkkoon kuuluu proteiini B4: n (tähden) aiheuttama häiriö, joka jotenkin etenee verkoston läpi vaikuttaakseen jotenkin proteiinien B6 ja B7 väliseen yhteyteen (leveä palkki). Tämä ei tarkoita, että proteiini B4 olisi fyysisesti vuorovaikutuksessa joko B6: n tai B7: n kanssa; vaikutuksen eteneminen proteiinin vuorovaikutusverkoston kautta voi johtua suorista fysikaalisista sidoksista tai entsymaattisista prosesseista, jotka eivät ole ilmeisiä verkostossa.
päätelmä
kumppanuus-ja yhteistyösopimuksen kehittäminen ja soveltaminen on vielä kesken. Esimerkiksi tässä kuvattujen rajallisten, joskin informatiivisten sovelluskokonaisuuksien lisäksi strategiaa sovelletaan kokonaisten genomien laajamittaiseen seulontaan. Kehittyneempiä ongelmia proteiinin suunnittelu ja proteiinin taitto on tutkittu, mukaan lukien tutkimuksia tekijöistä, jotka ohjaavat valintaa sekvenssien optimaalista vuorovaikutusta proteiinien, proteiinien ja nukleiinihappojen, ja proteiinien ja pienten orgaanisten molekyylien. Kumppanuus-ja yhteistyösopimus on hyvin yleinen ja joustava kokeellinen lähestymistapa, ja siksi meidän pitäisi odottaa näkevämme lähitulevaisuudessa yhä useampia tämän perustyökalun uusia sovelluksia molekyyli-ja solubiologian alalla.
tunnustukset
Stephen Michnickillä on Kanadan integratiivisen genomiikan Tutkimustuoli. Laboratoriomme tutkimusta rahoitti Canadian Institutes of Health Research.
- 1. Pelletier, J. N., F. X. Campbell-Valois ja S. W. Michnick. 1998. Oligomerisaatio-domeeni-suunnattu aktiivisen dihydrofolaattireduktaasin uudelleenkokoaminen rationaalisesti suunnitelluista fragmenteista. Proc. Natl. Acad. Sci. USA 95: 12141-12146.Crossref, Medline, CAS, Google Scholar
- 2. Remy, I. Ja S. W. Michnick. 1999. Proteiinin interaktioiden klooninen valinta ja in vivo-kvantitaatio proteiinifragmenttien komplementaatiomääritysten kanssa. Proc. Natl. Acad. Sci. USA 96: 5394-5399.Crossref, Medline, CAS, Google Scholar
- 3. Galarneau, A., M. Primeau, L. E. Trudeau ja S. W. Michnick. 2002. Beetalaktamaasiproteiinifragmenttien komplementaatiomääritykset ovat proteiiniproteiinien vuorovaikutusten in vivo-ja in vitro-sensoreita. Nat. Bioteknologiaa. 20:619–622.Crossref, Medline, CAS, Google Scholar
- 4. Wehrman, T., B. Kleaveland, J. H. Her, R. F. Balint ja H. M. Blau. 2002. Proteiinien ja proteiinien yhteisvaikutuksia seurataan nisäkässoluissa beetalaktamaasientsyymifragmenttien täydentymisen kautta. Proc. Natl. Acad. Sci. USA 99: 3469-3474.Crossref, Medline, CAS, Google Scholar
- 5. Spotts, J. M., R. E. Dolmetsch ja M. E. Greenberg. 2002. Dynaamisen fosforylaatiosta riippuvan proteiini-proteiini-vuorovaikutuksen Time-lapse-kuvantaminen nisäkässoluissa. Proc. Natl. Acad. Sci. USA 99: 15142-15147.Crossref, Medline, CAS, Google Scholar
- 6. Remy, I. Ja S. W. Michnick. 2006. Erittäin herkkä proteiini-proteiini-yhteisvaikutustesti, joka perustuu Gaussia-lusiferaasiin. Nat. Menetelmät 3: 977-979.Crossref, Medline, CAS, Google Scholar
- 7. Ghosh, I., A. D. Hamilton ja L. Regan. 2000. Antiparallel leusiini vetoketju-suunnattu proteiini uudelleenkokoonpano: soveltaminen vihreä fluoresoiva proteiini. J. Am. Kemiaa. Soc. 122:5658–5659.Crossref, CAS, Google Scholar
- 8. Hu, C. D., Y. Chinenov ja T. K. Kerppola. 2002. Visualisointi vuorovaikutuksista bzip-ja Rel-perheen proteiinien välillä elävissä soluissa käyttäen bimolekulaarista fluoresenssia. Mol. Selli 9: 789-798.Crossref, Medline, CAS, Google Scholar
- 9. Remy, I. Ja S. W. Michnick. 2004. CDNA-kirjaston funktionaalinen seulontastrategia, joka perustuu fluoresoivien proteiinien komplementaatiomäärityksiin, tunnistaa signalointireittien uudet komponentit. Methods 32: 381-388.Crossref, Medline, CAS, Google Scholar
- 10. Remy, I., F. X. Campbell-Valois, G. Ghaddar, S. Aquin ja S. W. Michnick. 2005. Detection of protein interactions and library screening with protein-fragment complementation assays, s. 637-672. In Protein-Protein Interactions: A Molecular Cloning Manual, 2nd ed. CSH Laboratory Press, Cold Spring Harbor, NY.Google Scholar
- 11. Paulmurugan, R. ja S. S. Gambhir. 2003. Proteiinin ja proteiinin yhteisvaikutusten seuranta käyttämällä synteettisen renilla-lusiferaasiproteiinin fragmentti-avusteista täydentämistä. Anaali. Kemiaa. 75:1584–1589.Crossref, Medline, CAS, Google Scholar
- 12. Paulmurugan, R., Y. Umezawa ja S. S. Gambhir. 2002. Proteiini-proteiini-interaktioiden Noninvasive-kuvantaminen elävillä koehenkilöillä käyttäen reporter-proteiinin täydentämis-ja ennallistamisstrategioita. Proc. Natl. Acad. Sci. USA 99: 15608-15613.Crossref, Medline, CAS, Google Scholar
- 13. Luker, K. E., M. C. Smith, G. D. Luker, S. T. Gammon, H. Piwnica-Worms ja D. Piwnica-Worms. 2004. Kontrolloitujen proteiini-proteiini-interaktioiden kinetiikka, joka on havaittu firefly-luciferaasi-komplementaatiokuvauksessa soluissa ja elävissä eläimissä. Proc. Natl. Acad. Sci. USA 101: 12288-12293.Crossref, Medline, CAS, Google Scholar
- 14. Jach, G., M. Pesch, K. Richter, S. Frings ja J. F. Uhrig. 2006. Parannettu mRFP1 lisää punaista bimolekulaariseen fluoresenssiin. Nat. Menetelmät 3: 597-600.Crossref, Medline, CAS, Google Scholar
- 15. Remy, I., A. Montmarquette ja S. W. Michnick. 2004. PKB / Akt moduloi TGF-beta-signalointia suoran vuorovaikutuksen kautta Smad3: n kanssa. Nat. Cell Biol. 6:358–365.Crossref, Medline, CAS, Google Scholar
- 16. Remy, I. Ja S. W. Michnick. 2001. Biokemiallisten verkostojen visualisointi elävissä soluissa. Proc. Natl. Acad. Sci. USA 98: 7678-7683.Crossref, Medline, CAS, Google Scholar
- 17. Macdonald, M. L., J. Lamerdin, S. Owens, B. H. Keon, G. K. Bilter, Z. Shang, Z. Huang, H. Yu, et al.. 2006. Tunnistamalla huumeiden ei-kohde-vaikutuksia ja piileviä fenotyyppejä ihmissoluissa. Nat. Kemiaa. Biol. 2:329–337.Crossref, Medline, CAS, Google Scholar
- 18. Pelletier, J. N., K. M. Arndt, A. Pluckthun ja S. W. Michnick. 1999. In vivo kirjasto-vs. kirjasto-valikoima optimoituja proteiini-proteiini-vuorovaikutuksia. Nat. Bioteknologiaa. 17:683–690.Crossref, Medline, CAS, Google Scholar
- 19. Remy, I. A. Wilson ja S. W. Michnick. 1999. Erytropoietiinireseptorin aktivaatio ligandin indusoimalla konformaatiomuutoksella. Tiede 283: 990-993.Crossref, Medline, CAS, Google Scholar
- 20. Gegg, C. V., K. E. Bowers ja C. R. Matthews. 1997. Tutkin dihydrofolaattireduktaasin minimaaliset riippumattomat taittoyksiköt molekyylidissektiolla. Protein Sci. 6:1885–1892.Crossref, Medline, CAS, Google Scholar
- 21. Rossi, F., C. A. Charlton ja H. M. Blau. 1997. Proteiini-proteiini-interaktioiden seuranta koskemattomissa eukaryoottisoluissa beeta-galaktosidaasin komplementaatiolla. Proc. Natl. Acad. Sci. USA 94: 8405-8410.Crossref, Medline, CAS, Google Scholar
- 22. Ozawa, T., S. Nogami, M. Sato, Y. Ohya ja Y. Umezawa. 2000. Fluoresoiva indikaattori proteiinien ja proteiinien välisten interaktioiden havaitsemiseksi in vivo proteiinien yhteyttämisen perusteella. Anaali. Kemiaa. 72:5151–5157.Crossref, Medline, CAS, Google Scholar
- 23. Magliery, T. J., C. G. Wilson, W. Pan, D. Mishler, I. Ghosh, A. D. Hamilton ja L. Regan. 2005. Proteiini-proteiini-vuorovaikutusten havaitseminen vihreän fluoresoivan proteiinifragmentin uudelleenkokoamisloukku: laajuus ja mekanismi. J. Am. Kemiaa. Soc. 127:146–157.Crossref, Medline, CAS, Google Scholar
- 24. Nyfeler, B., S. W. Michnick ja H. P. Hauri. 2005. Syömällä proteiinien vuorovaikutuksia elävien solujen eritysreitillä. Proc. Natl. Acad. Sci. USA 102: 6350-6355.Crossref, Medline, CAS, Google Scholar
- 25. Arndt, K. M., J. N. Pelletier, K. M. Muller, T. Alber, S. W. Michnick ja A. Pluckthun. 2000. Heterodimeerinen kelattu peptidipari, joka on valittu in vivo suunnitellusta kirjasto vastaan kirjasto-kokonaisuudesta. J. Mol. Biol. 295:627–639.Crossref, Medline, CAS, Google Scholar
- 26. Remy, I. Ja S. W. Michnick. 2004. Apoptoosin säätely Ft1-proteiinilla, joka on proteiinikinaasi B/Akt: n uusi modulaattori. Mol. Solu. Biol. 24:1493–1504.Crossref, Medline, CAS, Google Scholar
- 27. Ding, Z., J. Liang, Y. Lu, Q. Yu, Z. Songyang, S. Y. Lin ja G. B. Mills. 2006. Retroviruspohjainen proteiinin komplementaatiomääritysnäyttö paljastaa toiminnalliset AKT1-sitovat kumppanit. Proc. Natl. Acad. Sci. USA 103:15014–15019.Crossref, Medline, CAS, Google Scholar
- 28. Cody, V., J.R. Luft, E. Ciszak, T.I. Kalman, and J.H. Freisheim. 1992. Crystal structure determination at 2.3 A of recombinant human dihydrofolate reductase ternary complex with NADPH and methotrexate-gamma-tetrazole. Anticancer Drug Des. 7:483–491.Medline, CAS, Google Scholar