A fehérje-fragmentum komplementációs vizsgálatok alkalmazása a sejtbiológiában
- Bevezetés
- elv
- korlátozások
- Standard kontrollok egy PCA vizsgálathoz
- a PCA alkalmazása a Fehérjetervezésben: Könyvtár vs.az optimálisan kölcsönhatásba lépő fehérjék könyvtári szűrése
- a PCA alkalmazása cDNS könyvtári szűrésre emlős sejtekben
- a PCA használata molekuláris Vonalzóként: Receptor vizsgálatok
- biokémiai hálózatok feltérképezése
- következtetés
- Köszönetnyilvánítás
Bevezetés
a biokémiai útvonalak valójában a fehérje komplexek dinamikus összeszerelésének és szétszerelésének rendszerei, ezért a modern biológiai kutatások nagy része azzal foglalkozik, hogy a fehérjék hogyan, mikor és hol lépnek kölcsönhatásba a biokémiai folyamatokban részt vevő más fehérjékkel. A fehérje-fehérje kölcsönhatások tanulmányozásának egyszerű megközelítései iránti igény, különösen nagy léptékben, a közelmúltban nőtt a genomprojektek előrehaladásával, mivel az ismeretlen társítása ismert géntermékekkel az egyik kulcsfontosságú módszer a gén funkciójának megállapítására. Ezt a kihívást szem előtt tartva fejlesztette ki laboratóriumunk fehérje-fragmentum komplementációs vizsgálatokat (PCAs). Ebben a stratégiában két érdekes fehérje (a és B fehérjék) fuzionálódik egy riporter fehérje komplementer fragmenseivel (enzim, fluoreszcens fehérje stb.). Ha az A és B fehérjék kölcsönhatásba lépnek, a riporter fragmensei összeállnak, a riporter natív struktúrájába hajtogatódnak, és helyreállítják annak aktivitását (1.ábra). A PCA reporter fehérjéket úgy választották ki, mint amelyek különféle kimutatható tevékenységeket termelnek, beleértve a fluoreszcens, lumineszcens és kolorimetrikus jeleket, valamint az egyszerű túlélési szelekciós vizsgálatokat (1-14). Bizonyítottuk, hogy a PCA stratégia a következő képességekkel rendelkezik: (i) lehetővé teszi a fehérje-fehérje kölcsönhatások kimutatását in vivo és in vitro bármilyen sejttípusban; (ii) lehetővé teszi a fehérje-fehérje kölcsönhatások kimutatását a megfelelő szubcelluláris rekeszekben vagy organellákban; (iii) lehetővé teszi az olyan kölcsönhatások kimutatását, amelyek kifejezetten a fejlődési, táplálkozási, környezeti vagy hormon által indukált jelekre reagálnak; (iv) lehetővé teszi a sejtekben a fehérje-összeállítás kinetikai és egyensúlyi aspektusainak nyomon követését; és (v) lehetővé teszi az új fehérje-fehérje kölcsönhatások szűrését bármilyen sejttípusban (2,3,6,9) (15-19).
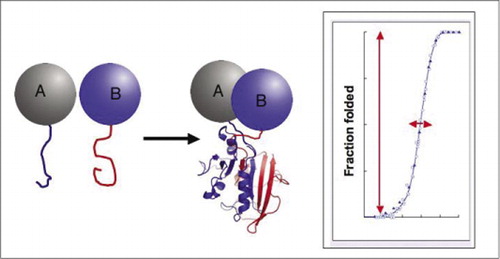
ha a két fehérje kölcsönhatásba lép, a reporter fragmentumok összeállnak, a reporter protein natív szerkezetébe hajtogatódnak, és aktivitása helyreáll (balra). Ezek a fehérje-fragmentum komplementációs vizsgálatok (PCAs) fizikai tulajdonságokkal rendelkeznek, amelyek különösen hasznosak a dinamikus fehérje komplexek riportereként. A jobb oldalon egy fehérje hajtogatási görbe található, ahol az x tengely valamilyen változó paraméter (pl., az egyik fragmens koncentrációja a másikhoz képest). Ennek a folyamatnak a magas kooperativitása (a hajtogatott Fajok frakciójának rendkívül éles növekedése egy nagyon szűk tartományban) azt jelenti, hogy a vizsgálatok hatalmas dinamikatartományúak, így egy komplex kimutatása virtuális mindent vagy semmit jelenség. Ez ellentétben áll az olyan módszerekkel, mint a fluoreszcencia rezonancia energiaátvitel (FRET), amely nagyon alacsony dinamikatartományú, és számos paraméter gondos optimalizálását igényli. Ezzel szemben a fehérje komplex képződésének PCA általi mérése nem nehezebb, mint az intakt riporter enzim aktivitásának mérése.
elv
bemutattuk a PCA elvét, kezdve a dihidrofolát-reduktáz enzimmel (DHFR), mint riporter (1). Nyilvánvaló volt, hogy ha az enzimnek a fragmenseiből történő hajtogatása (amint azt az aktivitás feloldásával detektáltuk) teljesen függ a kölcsönhatásban lévő fehérjék összekapcsolódásától, akkor a leírt rendszer valójában a kölcsönhatások detektora. Mi és mások azóta bebizonyítottuk, hogy ez az elv számos enzimre általánosítható, beleértve a Gaussia és a Renilla luciferázokat, a TEM-laktamázt, valamint a zöld fluoreszcens fehérjét (GFP) és annak variánsait (1-14). A PCA-fragmensek döntő jellemzője, hogy úgy vannak kialakítva, hogy ne hajtódjanak spontán módon anélkül, hogy a fehérjék kölcsönhatása közvetlen közelségbe hozná őket (1,20). Ha spontán hajtogatás történt, a PCA egyszerűen nem fog működni. A spontán hajtogatás hamis pozitív jelhez vezetne, olyan helyzethez, amely reménytelenül megzavarja a könyvtári képernyők in vivo értelmezését (várhatóan fontos alkalmazás). A PCA-val ellentétben léteznek olyan, a PCA-hoz hasonló, de fogalmilag és gyakorlatilag eltérő (21,22), DG-galaktozidázon és split inteineken alapuló vizsgálati rendszerek. Mindkét esetben az enzimek jól ismert, természetesen előforduló és spontán asszociáló alegységei egymással kölcsönhatásban lévő fehérjékhez kapcsolódnak. A központi probléma itt az, hogy az alegységek, még ha gyengén is társulnak, mindig képesek erre bizonyos mértékig, ami azt jelenti, hogy a spontán összeszerelés állandó háttere van.
korlátozások
a PCA stratégia általános abban az értelemben, hogy nem korlátozódik egyetlen enzimriporterre, és több különböző formában dolgozták ki, amelyek mindegyike a legalkalmasabb egy adott kérdés kezelésére. Például az egyszerű túlélési szelekciós PCA-k, például a DHFR-en alapuló PCA-k a leghasznosabbak a könyvtári kiválasztáshoz, míg a lumineszcencia vagy fluoreszcencia leolvasás PCA-k a legjobbak a fehérje komplexek térbeli és időbeli dinamikájának tanulmányozásához. Mivel a fúziós fehérjék olyan sejtekben expresszálódhatnak, amelyek releváns modellek egy adott biokémiai út tanulmányozásához, valószínűleg natív biológiai állapotukban vannak, beleértve a helyes poszttranszlációs módosításokat is (nyilvánvalóan maguk a PCA-fragmensek nem zavarhatják a fehérjék célzását vagy módosítását, és ezt meg kell vizsgálni).
a legegyszerűbb és ezért legnépszerűbb PCA-k közé tartoznak a fluoreszcens fehérjék (például GFP és variánsok), mivel a jelet a belső fluorofor (7-9)(14,15,17,23) biztosítja. A fluoreszcens fehérjéket azonban magas szinten kell expresszálni annak biztosítása érdekében, hogy a jel a háttér sejtes fluoreszcencia felett legyen, és a fluoreszcens protein PCA-k irreverzibilisnek bizonyultak, ami hasznos lehet (ritka komplexek csapdába ejtése és vizualizálása), de a forgalom félreértelmezéséhez vagy a kölcsönható fehérjék lokalizációjához is vezethet (8,23,24). Másfelől a DHFR-en és a Ca-n alapuló PCAs-ok, mint riporterek, közvetett bizonyítékok alapján reverzibilisnek bizonyultak az interakciók megszakadása után, míg a Gaussia luciferázon alapuló PCA-k közvetlenül reverzibilisnek bizonyultak (2,3,6). A PCA reverzibilitása tehát lehetővé teszi a fehérje komplex összeszerelésének és szétszerelésének kinetikai és egyensúlyi aspektusainak kimutatását az élő sejtekben (2.ábra).
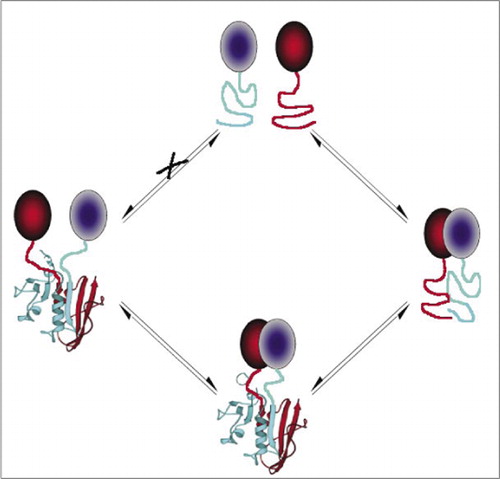
ez megakadályozza a töredékek spontán társulását (x út), amely hamis jelhez vezethet. Ugyanígy olyan fragmenseket választanak ki, amelyeknél a fragmensek spontán kibontakozása akkor következik be, amikor a fehérje komplex megszakad (bal oldal).
Standard kontrollok egy PCA vizsgálathoz
a PCA stratégia megköveteli, hogy a riporter fehérje fragmensei összegyűljenek és összehajtódjanak, miután a kérdéses fehérjék komplexet képeztek. A riporter összeszerelése és helyes hajtogatása függ mind a riporter fehérjéire jellemző szerkezeti geometria, mind a kölcsönhatásban lévő fehérjék által alkotott komplex visszanyerésétől. Ez a PCA-vizsgálatok egyik fő megkülönböztetése a fluoreszcens rezonancia energiaátvitelhez (FRET) vagy a biolumineszcencia rezonancia energiaátvitelhez (BRET) vagy az élesztő két hibrid vizsgálatokhoz képest, és ez a tulajdonság lehetővé tette számunkra, hogy az eritropoetin receptor szerkezetalapú vizsgálatát végezzük (19). Jellemzően egy 10 aminosavból álló rugalmas polipeptid-linkert helyezünk be, amely a következőkből áll: (Gly.Gly.Gly.Gly.Ser) 2 az érdekes fehérje és a PCA riporter fragmentum között (mindkét fúzió esetében). Ezt a linkert azért választottuk, mert ez a lehető legrugalmasabb, és empirikusan megfigyeltük, hogy az ilyen hosszúságú linkerek elég hosszúak ahhoz, hogy a fragmensek megtalálják egymást és összehajoljanak, függetlenül a kölcsönhatásban lévő fehérjék méretétől, amelyekhez a fragmensek összeolvadnak (16).
annak biztosítása érdekében, hogy a nem specifikus válaszok ne forduljanak elő, egy sor ellenőrzést kell végrehajtani. Ezek a kontrollok a következőket foglalhatják magukban, bár az első a legfontosabb: (i) nem kölcsönhatásba lépő fehérjék. PCA-választ nem szabad megfigyelni, ha nem kölcsönhatásba lépő fehérjéket használnak PCA-partnerként; a nem kölcsönhatásban lévő fehérje túlzott expressziója önmagában nem versenyezhet az ismert kölcsönhatásért. (ii) Partner fehérje interfész mutációk. A partner pont-vagy deléciós mutációjának, amelyről ismert, hogy megzavarja az interakciót, szintén meg kell akadályoznia a PCA-választ. (iii) verseny. A PCA-választ csökkenteni kell az egyik vagy a másik kölcsönhatásban lévő fehérje egyidejű túlexpressziójával, amely nem fuzionálódik egy komplementer PCA-fragmenshez. (iv) fragmentum csere. Két fehérje között megfigyelt kölcsönhatásnak akkor is meg kell történnie, ha a fehérjéket kicserélik a megfelelő riporter fragmensekkel.
a PCA alkalmazása a Fehérjetervezésben: Könyvtár vs.az optimálisan kölcsönhatásba lépő fehérjék könyvtári szűrése
a PCA első alkalmazásai között szerepelt egy fehérje tervezési probléma. A DHFR PCA assay-t Escherichia coli-ban használták a komplementer tervezésű leucin cipzárképző szekvenciák két könyvtárának szűrésére 1010 potenciális kölcsönhatásban lévő párral, amelyek közül gyakorlatilag 106-ot tudtunk lefedni. Megmutattuk, hogy a PCA képernyő mind az optimális kötési specificitás, mind az oldhatóság és a kölcsönhatásban lévő cipzárak expressziója szempontjából kiválasztott (18,25). Ennek a megközelítésnek a legfontosabb jellemzője, hogy két könyvtárat egyszerre lehetett egymás ellen szűrni, ezt a folyamatot összehasonlítható élesztő két hibrid képernyőkkel nem lehet könnyen elérni. Ennek a megközelítésnek az egyszerűsége és a tervezési stratégiáról kapott információk sajátos jellege arra utal, hogy a DHFR PCA széles körben alkalmazható a fehérje tervezésében és az irányított evolúciós kísérletekben. Azt is mutatja, hogy a PCA kiegészíti a fágmegjelenítési stratégiákat, mivel a teljes kiválasztási, optimalizálási és szigorúsági teszteket in vivo végzik, így ez a megközelítés könnyen végrehajtható.
a PCA alkalmazása cDNS könyvtári szűrésre emlős sejtekben
az új géntermék funkciójának meghatározásának első lépése annak meghatározása kölcsönhatások más géntermékekkel. A tisztán fehérje interakción alapuló szűrési megközelítés (például élesztő két hibrid) azonban korlátozott, mert csak azt mondja, hogy két fehérje kölcsönhatásba lép, miközben nem nyújt más információt, amely összekapcsolhatja a fehérjét a funkciójával. Ezért megmutattuk, hogy a PCA használható egy cDNS könyvtár szűrési stratégiában, amely egyesíti az egyszerű sejtalapú fehérje interakciós képernyőt specifikus funkcionális vizsgálatokkal, amelyek biztosítják az interakció biológiai relevanciájának kezdeti validálását (9). Az első lépés a csali és a cDNS-kódolt zsákmányfehérjék könyvtárának fizikai kölcsönhatásainak szűrése, a PCA riporter ép élő sejtekben történő helyreállításának nyomon követésével. Ennek az első lépésnek az a fontos jellemzője, hogy a kölcsönhatások közvetlenül kimutathatók a teljes hosszúságú fehérjék között azokban a sejtekben, amelyekben a csali fehérje normálisan működik, ezáltal biztosítva a szükséges szubcelluláris célzást, poszttranszlációs módosításokat és kölcsönhatásokat más fehérjékkel. Nyilvánvaló, hogy a kísérleti érvényesség érdekében bizonyítani kell, hogy a PCA fragmensek nem zavarják a fehérjék célzását vagy módosítását. A második lépésben a fehérje kölcsönhatása funkcionálisan validálható, az alábbiak szerint: először is, a PCA által detektált fehérje kölcsönhatást olyan szerekkel, például hormonokkal vagy specifikus inhibitorokkal kell megzavarni, amelyekről ismert, hogy modulálják azt a specifikus biokémiai utat, amelyben a fehérjék részt vesznek. Ezt bizonyítottuk a DHFR PCA esetében, és ezt a tulajdonságot használtuk az élő emlőssejtek jelátviteli útvonalainak feltérképezésére (16). Másodszor, a fehérje interakció szubcelluláris lokalizációja, amelyet ismét a PCA detektál, megváltoztathatók az utat moduláló szerek. Így a PCA-alapú szűrési stratégia ötvözi az egyszerű szűrési lépést a közvetlen funkcionális vizsgálatokkal. Mi és mások ezt a stratégiát alkalmazták a szerin/treonin protein kináz, PKB/Akt (9,15,26,27) új szubsztrátjainak vagy szabályozóinak azonosítására.
a PCA használata molekuláris Vonalzóként: Receptor vizsgálatok
a PCA stratégiák különlegessége, hogy ha ismerjük a riporter enzim háromdimenziós szerkezetét, akkor pontosan meg lehet jósolni, milyen közel kell lennie a fragmentumoknak ahhoz, hogy biztosítsuk, hogy az enzim megfelelően hajtogatódik és mérhető aktivitással rendelkezik. Ezt a tényt a dimer eritropoietin receptor (EpoR) DHFR PCA alkalmazásával történő aktiválásának strukturális alloszterikus modelljének tesztelésére alkalmazták, és a megközelítés kiterjeszthető az alloszterikus átmenetek tanulmányozására dimer vagy multimer fehérje interfészekben (19). Az EpoR esetében kimutatták, hogy a receptor dimer transzmembrán doméneket 73-mal választják el egymástól 6db, amint azt a nem kötött EpoR kristályszerkezetében megfigyelték. Úgy érveltek, hogy ha ez az inaktív állapot létezik egy élő sejt membránján, akkor a transzmembrán domének C végéhez fuzionált DHFR fragmensek csak akkor hajtódnak össze, ha egy ligandum olyan konformációs változást indukál, amely lehetővé teszi a fragmensek elég közel kerülését ahhoz, hogy biztosítsák a DHFR pontos háromdimenziós szerkezetének kialakulását (19,28). Ez megkövetelné, hogy a töredékek N végpontjai egymástól 8 fő legyen. A transzmembrán domén és a DHFR fragmensek közötti rugalmas linker peptidek behelyezése lehetővé tette számunkra, hogy megvizsgáljuk az extracelluláris domén dimer beillesztési pontjai közötti távolságot, és megerősítsük, hogy a DHFR-nek a töredékeiből való összehajtásához elég hosszú Linker-ekre volt szükség ahhoz, hogy a 73.
biokémiai hálózatok feltérképezése
az anyagcsere, a jelátviteli kaszkádok és a sejtciklus sejt biokémiai gépei példák a makromolekuláris komplexek dinamikus összeszerelésére és szétszerelésére. Ezeket úgy definiáljuk, hogy a kölcsönhatásban lévő fehérjéket csoportosítjuk a perturbációk (hormonok, metabolitok, enzimgátlók stb.). A fehérje-fehérje kölcsönhatások felhasználhatók egy ismeretlen funkciójú fehérje összekapcsolására olyan fehérjékkel, amelyekről ismert, hogy részt vesznek egy ismert biokémiai folyamatban. Kimutattuk, hogy a farmakológiai profilalkotás (Az útvonal-specifikus gyógyszerek és a fehérje hormonok fehérje-fehérje kölcsönhatásokra gyakorolt hatásainak monitorozása), valamint a fehérje-fehérje kölcsönhatások celluláris helyének meghatározása PCAs segítségével érhető el(9)(15-17)(26). Ezen eredmények elemzése lehetővé teszi annak ábrázolását, hogy a biokémiai hálózatok hogyan fejlődnek időben és térben, valamint a specifikus ingerekre adott válaszként. Elvi bizonyítékként beszámoltunk ennek a stratégiának az alkalmazásáról a receptor tirozin-kinázok (RTKs) által közvetített jelátviteli út feltérképezésére (16). A megfigyelt kölcsönhatások farmakológiai profilja és celluláris elhelyezkedése lehetővé tette számunkra, hogy az egyes géntermékeket az útvonalak releváns pontjára helyezzük (3.ábra). Elemzésünk eredményeiből kiderült az RTK hálózat szervezésének térképe, amely összhangban volt a meglévő modellekkel, de számos új interakciót is tartalmazott. Az a képesség, hogy megfigyeljük a fehérje kölcsönhatások hálózatát az élő sejtekben, amelyek tartalmazzák az alapul szolgáló útvonal összes összetevőjét, rejtett kapcsolatokat tártak fel, amelyeket korábban nem figyeltek meg, annak ellenére, hogy ezt a hálózatot intenzíven megvizsgálták. A bemutatott eredmények azt mutatják, hogy a PCA stratégia rendelkezik az Általános génfunkciók validálásához és az útvonal feltérképezéséhez szükséges jellemzőkkel. A PCA-k szélesebb körének közelmúltbeli alkalmazása lehetővé tette egy olyan általános megközelítés kidolgozását, amely összekapcsolja a kábítószerek hatását a specifikus jelátviteli útvonalakon, és felderíti a kábítószerek előre nem látható tevékenységeit (17).
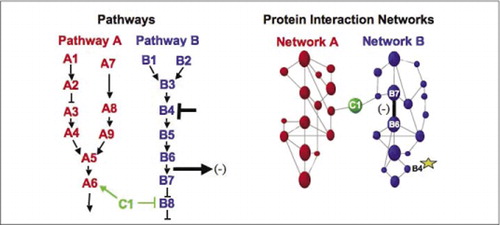
(balra) egy gátló perturbáló szer hatását, amely a B4 fehérjére (T-bar) hat, a B6 és B7 fehérjék egymással való kölcsönhatásának megváltozásával detektálják (nyíl). Ebben az esetben a perturbáció hatása az interakciós fehérje (-) számának csökkenése, amelyet az adott interakció riportere észlel (az interakció kimeneti jele, amelyet például a PCA sentinel észlelt). A hatás azonban ugyanolyan pozitív lehet, attól függően, hogy milyen következményekkel jár az upstream fehérje gátlása. (Jobbra) a B útvonal fehérje interakciós hálózatán belül a B4 fehérje (csillag) perturbációja valahogy terjed a hálózaton keresztül, hogy valahogy befolyásolja a B6 és B7 fehérjék közötti kapcsolatot (széles sávot). Ez nem jelenti azt, hogy a B4 fehérje fizikailag kölcsönhatásba lép B6 vagy B7; az affektus terjedése a fehérje interakciós hálózaton keresztül a közvetlen fizikai kapcsolatoknak vagy a hálózatban nem nyilvánvaló enzimatikus folyamatoknak tudható be.
következtetés
a PCA fejlesztése és alkalmazása még folyamatban van. Például, az itt leírt korlátozott, bár informatív alkalmazáskészletek mellett, a stratégiát teljes genomok nagyszabású szűrésére alkalmazzák. A fehérje tervezésének és a fehérje hajtogatásának kifinomultabb problémáit vizsgálják, beleértve azokat a tényezőket is, amelyek szabályozzák a fehérjék, fehérjék és nukleinsavak, valamint a fehérjék és a kis szerves molekulák közötti optimális kölcsönhatások szekvenciáinak kiválasztását. A PCA egy nagyon általános és rugalmas kísérleti megközelítés, ezért arra kell számítanunk, hogy a közeljövőben egyre több új alkalmazást fogunk látni ennek az alapvető eszköznek a molekuláris és sejtbiológiában.
Köszönetnyilvánítás
Stephen Michnick tartja a kanadai kutatási szék integratív genomika. A laboratóriumunkból idézett kutatást a Kanadai Egészségügyi kutatóintézetek finanszírozták.
- 1. Pelletier, J. N., F. X. Campbell-Valois és S. W. Michnick. 1998. Az aktív dihidrofolát-reduktáz oligomerizációs domén által irányított újraszerelése racionálisan megtervezett fragmensekből. Proc. NAT. Acad. Sci. USA 95: 12141-12146.Crossref, Medline, CAS, Google Tudós
- 2. Remy, I. és S. W. Michnick. 1999. A klonális szelekció és a protein-fragmentum komplementációs vizsgálatokkal való fehérje kölcsönhatások in vivo mennyiségi meghatározása. Proc. NAT. Acad. Sci. USA 96: 5394-5399.Crossref, Medline, CAS, Google Tudós
- 3. Galarneau, A., M. Primeau, L. E. Trudeau és S. W. Michnick. 2002. Béta-laktamáz protein fragmentum komplementációs vizsgálatok in vivo és in vitro protein kölcsönhatások érzékelői. Nat. Biotechnol. 20:619–622.Crossref, Medline, CAS, Google Tudós
- 4. Wehrman, T., B. Kleaveland, J. H. Her, R. F. Bálint és H. M. Blau. 2002. A fehérje-fehérje kölcsönhatásokat emlős sejtekben figyelték meg a béta-laktamáz enzim fragmensek kiegészítése révén. Proc. NAT. Acad. Sci. USA 99: 3469-3474.Crossref, Medline, CAS, Google Tudós
- 5. Spotts, J. M., R. E. Dolmetsch és M. E. Greenberg. 2002. Dinamikus foszforilációtól függő fehérje-fehérje kölcsönhatás időbeli leképezése emlős sejtekben. Proc. NAT. Acad. Sci. USA 99: 15142-15147.Crossref, Medline, CAS, Google Tudós
- 6. Remy, I. és S. W. Michnick. 2006. Nagyon érzékeny fehérje-fehérje interakciós vizsgálat Gaussia luciferáz alapján. Nat. Módszerek 3: 977-979.Crossref, Medline, CAS, Google Tudós
- 7. Ghosh, I., A. D. Hamilton és L. Regan. 2000. Antiparallel leucin cipzárral irányított fehérje összeszerelés: alkalmazás a zöld fluoreszcens fehérjéhez. J. Am. Kémia. Soc. 122:5658–5659.Crossref, CAS, Google Tudós
- 8. Hu, C. D., Y. Chinenov és T. K. Kerppola. 2002. A bZIP és a Rel család fehérjéi közötti kölcsönhatások vizualizálása élő sejtekben bimolekuláris fluoreszcencia komplementáció alkalmazásával. Mol. Cell 9: 789-798.Crossref, Medline, CAS, Google Tudós
- 9. Remy, I. és S. W. Michnick. 2004. A cDNS könyvtár funkcionális szűrési stratégiája fluoreszcens fehérje komplementációs vizsgálatokon alapul a jelátviteli utak új összetevőinek azonosítására. Módszerek 32: 381-388.Crossref, Medline, CAS, Google Tudós
- 10. Remy, I., F. X. Campbell-Valois, G. Ghaddar, S. Aquin és S. W. Michnick. 2005. Fehérje kölcsönhatások kimutatása és könyvtári szűrés protein-fragmentum komplementációs vizsgálatokkal, p. 637-672. Fehérje-fehérje kölcsönhatásokban: molekuláris klónozási kézikönyv, 2. kiadás. CSH laboratóriumi sajtó, hideg tavaszi kikötő, NY.Google Tudós
- 11. Paulmurugan, R. és S. S. Gambhir. 2003. Fehérje-fehérje kölcsönhatások monitorozása split szintetikus renilla luciferáz protein-fragmentum-asszisztált komplementáció alkalmazásával. Anális. Kémia. 75:1584–1589.Crossref, Medline, CAS, Google Tudós
- 12. Paulmurugan, R., Y. Umezawa és S. S. Gambhir. 2002. A fehérje-fehérje kölcsönhatások nem invazív képalkotása élő alanyokban riporter fehérje komplementációs és rekonstitúciós stratégiák alkalmazásával. Proc. NAT. Acad. Sci. USA 99: 15608-15613.Crossref, Medline, CAS, Google Tudós
- 13. Luker, K. E., M. C. Smith, G. D. Luker, S. T. Gammon, H. Piwnica-Worms, és D. Piwnica-Worms. 2004. A szabályozott fehérje-fehérje kölcsönhatások kinetikája a firefly luciferáz komplementációs képalkotásával derült ki sejtekben és élő állatokban. Proc. NAT. Acad. Sci. USA 101: 12288-12293.Crossref, Medline, CAS, Google Tudós
- 14. Jach, G., M. Pesch, K. Richter, S. Frings és J. F. Uhrig. 2006. A továbbfejlesztett mRFP1 vörös színt ad a bimolekuláris fluoreszcencia kiegészítéshez. Nat. Módszerek 3: 597-600.Crossref, Medline, CAS, Google Tudós
- 15. Remy, I., A. Montmarquette és S. W. Michnick. 2004. A PKB / Akt modulálja a TGF-béta jelátvitelt az Smad3-mal való közvetlen kölcsönhatás révén. Nat. Sejt Biol. 6:358–365.Crossref, Medline, CAS, Google Tudós
- 16. Remy, I. és S. W. Michnick. 2001. Biokémiai hálózatok megjelenítése az élő sejtekben. Proc. NAT. Acad. Sci. USA 98: 7678-7683.Crossref, Medline, CAS, Google Tudós
- 17. B. K. Bilter, Z. Shang, Z. Huang, H. Yu, M. L., J. Lamerdin, S. Owens, B. H. Keon, G. K. Bilter, Z. Shang, Z. Huang, H. Yu, et al.. 2006. Az emberi sejtekben található gyógyszerek céltól eltérő hatásainak és rejtett fenotípusainak azonosítása. Nat. Kémia. Biol. 2:329–337.Crossref, Medline, CAS, Google Tudós
- 18. Pelletier, J. N., K. M. Arndt, A. Pluckthun és S. W. Michnick. 1999. Az optimalizált fehérje-fehérje kölcsönhatások in vivo könyvtár-versus könyvtár kiválasztása. Nat. Biotechnol. 17:683–690.Crossref, Medline, CAS, Google Tudós
- 19. Remy, I., I. A. Wilson és S. W. Michnick. 1999. Az eritropoetin receptor aktiválása ligandum által kiváltott konformációváltozás által. Tudomány 283: 990-993.Crossref, Medline, CAS, Google Tudós
- 20. Gegg, C. V., K. E. Bowers és C. R. Matthews. 1997. Minimális független hajtogató egységek vizsgálata a dihidrofolát-reduktázban molekuláris boncolással. Protein Sci. 6:1885–1892.Crossref, Medline, CAS, Google Tudós
- 21. Rossi, F., C. A. Charlton és H. M. Blau. 1997. Fehérje-fehérje kölcsönhatások monitorozása intakt eukarióta sejtekben béta-galaktozidáz komplementációval. Proc. NAT. Acad. Sci. USA 94: 8405-8410.Crossref, Medline, CAS, Google Tudós
- 22. Ozava, T., S. Nogami, M. Sato, Y. Ohya és Y. Umezava. 2000. Fluoreszcens indikátor a fehérje-fehérje kölcsönhatások in vivo kimutatására a fehérje splicing alapján. Anális. Kémia. 72:5151–5157.Crossref, Medline, CAS, Google Tudós
- 23. Magliery, T. J., C. G. Wilson, W. Pan, D. Mishler, I. Ghosh, A. D. Hamilton és L. Regan. 2005. Fehérje-fehérje kölcsönhatások kimutatása zöld fluoreszcens fehérjefragmens újraszerelő csapdával: hatókör és mechanizmus. J. Am. Kémia. Soc. 127:146–157.Crossref, Medline, CAS, Google Tudós
- 24. Nyfeler, B., S. W. Michnick és H. P. Hauri. 2005. A fehérje kölcsönhatások rögzítése az élő sejtek szekréciós útjában. Proc. NAT. Acad. Sci. USA 102: 6350-6355.Crossref, Medline, CAS, Google Tudós
- 25. Arndt, K. M., J. N. Pelletier, K. M. Muller, T. Alber, S. W. Michnick és A. Pluckthun. 2000. Heterodimer tekercselt tekercs peptidpár in vivo kiválasztott egy tervezett könyvtár-versus-könyvtár együttesből. J. Mol. Biol. 295:627–639.Crossref, Medline, CAS, Google Tudós
- 26. Remy, I. és S. W. Michnick. 2004. Az apoptózis szabályozása az Ft1 fehérje, a protein kináz B/Akt új modulátora által. Mol. Cella. Biol. 24:1493–1504.Crossref, Medline, CAS, Google Tudós
- 27. Ding, Z., J. Liang, Y. Lu, Q. Yu, Z. Songyang, S. Y. Lin és G. B. Mills. 2006. A retrovírus – alapú fehérje komplementációs vizsgálati képernyő funkcionális AKT1-kötő partnereket tár fel. Proc. NAT. Acad. Sci. USA 103:15014–15019.Crossref, Medline, CAS, Google Scholar
- 28. Cody, V., J.R. Luft, E. Ciszak, T.I. Kalman, and J.H. Freisheim. 1992. Crystal structure determination at 2.3 A of recombinant human dihydrofolate reductase ternary complex with NADPH and methotrexate-gamma-tetrazole. Anticancer Drug Des. 7:483–491.Medline, CAS, Google Scholar